近年来,随着溴系阻燃剂(brominated flame retardants,BFRs)在全球范围内的限制使用,有机磷阻燃剂(organophosphate flame retardants,OPFRs)作为其优秀替代品,生产量和使用量正快速增长[1]。OPFRs兼具增塑剂等功能,广泛应用在塑料、润滑剂、橡胶制品、电子设备、纺织品、家具和食品包装等工业品中。中国已成为OPFRs生产和使用大国,并以年均15%的速率增长[2],因此越来越多的研究开始关注OPFRs的环境行为、生物富集和生态风险。
由于OPFRs主要是以添加(非化学键合)的形式存在于产品中,生产、使用和废弃过程会向周围环境释放,使其广泛分布于灰尘、室内空气、大气、地表水、沉积物和土壤等各种环境介质中[1-2]。我国太湖[3]、环渤海地区[4]和台湾地区[5]的地表水和沉积物中有大量OPFRs被检出。在世界各地,几乎所有生产的OPFRs都在海洋和淡水鱼类、禽类、昆虫和人类样品中检出[6]。其中,ΣOPFRs在瑞典的淡水鱼中富集水平可高达1 000 ng/g(以脂重计),而在西班牙的河流淡水鱼中发现高达2 423 ng/g的ΣOPFRs[7-8]。毒理学研究表明,所有OPFRs均具有不同强度的神经毒性和内分泌干扰效应[1-2]。由于OPFRs在各环境介质中大量分布,须对其在生物体内的富集情况和潜在生态风险进行研究。
不同结构的有机磷酸酯具有不同的物理化学性质和生态环境风险。OPFRs是磷酸酯类衍生物,根据酯基结构的不同,大致可分为3类:氯代(Cl-/Chlorinated OPFRs)、烷基取代(alkyl-OPFRs)和芳香基取代(aryl-OPFRs)有机磷酸酯。不同结构的OPFRs具有不同的物理化学特性。其中,芳香基取代OPFRs具有较高的正辛醇/水分配系数(Log KOW值),而氯代OPFRs比其他取代基的OPFRs更易溶于水[1, 9]。不同OPFRs的结构和极性的差异使其很难进行同步分析。目前,国内关于OPFRs检测方法的研究主要针对环境样品,包括地表水[10]、饮用水[11]、沉积物[12]、活性污泥[13]、灰尘[12]等。关于生物样品中OPFRs的检测方法和相关生物富集状况的研究相对较少,缺乏标准化分析方法。因此,建立生物样品中OPFRs快速、同步、有效的分析测定方法具有重要意义。
建立了9种OPFRs在鱼类组织中的固相萃取超高效液相色谱串联质谱(SPE-UPLC-MS/MS)分析方法。通过优化前处理条件、液相色谱和质谱检测条件,该方法可以最大限度地减少生物组织复杂基质的干扰,具有消耗溶剂少、精密度高、检出限低、准确度好、可对不同结构OPFRs同步分析等优点,实现对鱼类样品中OPFRs的分析。
1 材料与方法 1.1 仪器与设备Waters ACQUITY超高效液相色谱串联质谱仪,配置ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm×1.7 μm,美国沃特世公司);戴安ASE 350加速溶剂萃取仪(美国赛默飞世尔公司);IKA-A11分析研磨机(德国IKA公司);LGJ-18冷冻干燥机(北京松源华兴科技发展有限公司);HN 1006超声波清洗仪(中国华南超声设备厂);Supelco固相萃取装置(美国Supelco公司)。
1.2 试剂与标准品9种OPFRs标准品包括:磷酸三(2-氯乙基)酯(TCEP)、磷酸三(2-氯丙基)酯(TCIPP)、磷酸三(1, 3-二氯异丙基)酯(TDCPP)、磷酸三苯酯(TPHP)、磷酸三丁酯(TNBP)、磷酸三(丁氧基乙基)酯(TBOEP)、磷酸三(甲苯酯)(TCP)、2-乙基己基二苯基磷酸酯(EHDPHP)、磷酸三(2-乙基己基)酯(TEHP),均购于Accustandard公司(美国),纯度均>99%。内标物TDCIPP-d15(纯度为99%),购于Toronto Research Chemicals公司(加拿大)。所有有机溶剂均为HPLC级。硅藻土为ASE 350加速溶剂萃取仪专用,均购于赛默飞世尔公司(美国)。用水均为超纯水(美国Millipore公司)。
其他实验设备包括:0.22 μm玻璃纤维滤膜及抽滤装置(美国Millipore公司);GHP针头过滤器(13 mm×0.2 μm,美国Pall公司)。
1.3 萃取和净化条件利用鲫鱼肌肉组织进行前处理。鲫鱼购自广州某大型超市,长约(20±6) cm,质量(212±15) g。取新鲜鲫鱼,获取鱼体腹部和背部肌肉(去皮),切成小块后,用冷冻干燥机冷冻干燥96 h(-50 ℃),计算肌肉样品的含水量,样品保存于-50 ℃。然后将冷冻干燥的肌肉样品用分析研磨机粉碎,粉碎混合均一化后,称取鱼肉干粉200 mg,加入硅藻土(质量比为1:1),转入ASE萃取池,加入回收率指示物标液(TDCIPP-d15,20 ng)。于100 ℃、10.3 MPa下,由ASE加速萃取,萃取溶液为正己烷(HEX)/二氯甲烷(DCM)混合溶液(V/V=1:1),循环3次。将5 g无水硫酸钠加入萃取液接收瓶中,以除去多余的水分;取体积分数为10%的萃取液样品进行粗脂肪含量测定,测定方法参照《食品中脂肪的测定》(GB/T 5009.6—2003),蒸去溶剂后称重得出。
剩余萃取液用Bond Elut NH2固相萃取柱(1 g/6 mL,美国安捷伦公司)进行富集和净化。优化了上样溶液和淋洗液中二氯甲烷和正己烷的体积比。将ASE萃取液旋转蒸发至5 mL后,配置为不同溶剂比例的上样溶液,并选择适合的溶剂进行洗脱。淋洗液经氮吹置换溶剂为甲醇,加入内标化合物并定容至1 mL,过0.2 μm GHP膜后,置于棕瓶-20 ℃保存,待测。同时,制备实验室空白样品(LRB)、加标样品(LFB)各6个。实验室空白样品用200 mg硅藻土代替鱼肉干粉,加标样品由200 mg鱼肉干粉加20 μg OPFRs混合标液混匀制成。
1.4 液相色谱质谱条件超高效液相色谱(UPLC)条件:Waters BEH C18色谱柱(2.1 mm × 100 mm×1.7 μm),柱温40 ℃。流动相为1%甲酸溶液(A)和乙腈(B)(V/V),流量为0.3 mL/min。流动相梯度为:0 min,40% B;1~4 min, 65% B;5.5 min,85% B;8~12 min,95% B;12.1 min,40% B。
串联质谱(MS/MS)条件:采用电喷雾离子源(ESI),正离子扫描下,多反应监测(MRM)模式,对锥孔电压和碰撞能量等参数进行优化(表 1)。优化质谱条件后,峰宽分辨率0.7 m/z,喷雾电压4 500 V,毛细管温度300 ℃,碰撞气压0.199 Pa(Ar)。
| 表 1 OPFRs的离子转换、质谱条件、保留时间和仪器检出限① |
在以往的研究中,往往通过固相吸附法净化去除鱼类样品中共萃取的脂质、可溶性盐、氨基酸等物质基质干扰,是一种快速、简单且节省溶剂的净化手段。常用的固相吸附剂为氧化铝、多种官能团键合的硅胶、硅酸镁载体及高分子树脂等材料[14]。其中,氨基键合硅胶的固相萃取柱在对生物样品(鸟类卵)的OPFRs前处理净化中已有一定应用[15]。氨基和OPFRs的磷酸酯基团具有极性作用力,可以在非极性溶剂中避免吸附脂质的前提下对OPFRs进行吸附,并利用偏极性溶剂对吸附的OPFRs进行洗脱,从而达到净化效果。因此,选取了氨基柱(Bond Elut NH2)为萃取柱,对固相萃取过程上样、淋洗和洗脱条件进行优化,使其同时对鱼类样品中不同极性的OPFRs达到较好的净化效果。上样液、淋洗液、洗脱液及加速萃取溶剂对9种OPFRs的影响见图 1(a)(b)(c)(d)。
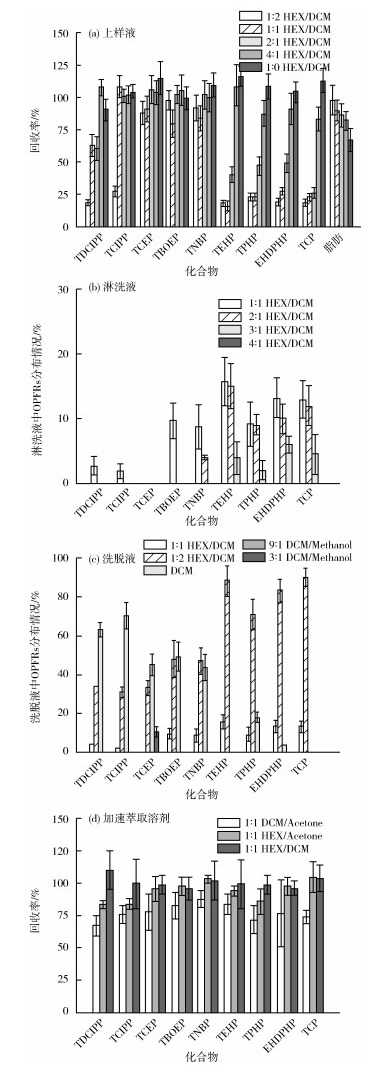
|
图 1 上样液、淋洗液、洗脱液及加速萃取溶剂对9种OPFRs的影响 |
首先,考察了不同极性固相萃取上样溶液对9种OPFRs回收率的影响,见图 1(a)。将OPFRs配置于1:2、1:1、2:1、4:1、1:0(V/V)的5组正己烷/二氯甲烷溶液中,分别通过氨基柱,测定OPFRs的回收率。同时,将花生油配置于各上样溶液中,以测定粗脂肪的去除效果。结果显示,随着上样溶液极性的降低,各OPFRs的回收率逐渐提高,且体积比>4:1的正己烷/二氯甲烷溶液可使大多数OPFRs富集于固相萃取柱中。然而,随着上样溶液极性的降低,粗脂肪的去除率逐渐升高,纯正己烷作为上样溶液时,只有61.9 %的脂肪去除率,见图 1(a)。其次,优化了淋洗液中二氯甲烷和正己烷的混合比例。配置不同比例的二氯甲烷和正己烷淋洗液(体积比分别为1:1、2:1、3:1、4:1),经氨基柱活化、上样等步骤后,分别使用不同极性的淋洗液进行淋洗,考察各OPFRs在不同淋洗液中的分布情况,见图 1(b)。与上样溶液优化的结果接近,4:1(V/V)的正己烷/二氯甲烷中没有OPFRs的检出。因此,为寻求脂肪去除和OPFRs保留的平衡,使用4:1(V/V)的正己烷/二氯甲烷溶液作为氨基固相萃取柱的上样溶液,即由1:1(V/V)的正己烷/二氯甲烷加速萃取生物样品后,将萃取液旋转蒸发至1 mL后,加入20 mL 4:1(V/V)的正己烷/二氯甲烷,混匀上样。经这一过程,可去除鱼类样品中约78.3%的粗脂肪。
另外,考察了不同洗脱溶液对9种OPFRs回收率的影响。设置了5种不同极性的洗脱液:1:1(V/V)的正己烷/二氯甲烷、1:2(V/V)的正己烷/二氯甲烷、二氯甲烷、9:1(V/V)的二氯甲烷/甲醇(Methanol)、3:1 (V/V)的二氯甲烷/甲醇。重新用标准物质过氨基柱净化后,依次用4 mL上述溶液洗脱,并测定洗脱液中的OPFRs含量,结果见图 1(c)。结果显示,第一、第五部分的洗脱液中均无OPFRs被检出,而1:1(V/V)的正己烷/二氯甲烷、二氯甲烷中各有较高比例的OPFRs被检出,9:1(V/V)的二氯甲烷/甲醇也有少量的TCEP被检出。所以,设置的氨基柱的洗脱溶液依次为:4 mL 1:1 (V/V)的正己烷/二氯甲烷、8 mL的二氯甲烷和4 mL 9:1(V/V)的二氯甲烷/甲醇。
最后,探讨了不同溶液对鱼类样品中OPFRs的萃取效率的影响。对于非极性化合物的加速溶剂萃取法常用的溶剂为正己烷、二氯甲烷和丙酮(Acetone)的1:1 (V/V)组合。所以对两两组合3种加速溶剂萃取条件下各OPFRs的回收率进行测定,即1:1 (V/V)的正己烷/二氯甲烷、1:1 (V/V)的正己烷/丙酮和1:1(V/V)的二氯甲烷和丙酮,结果如图 1(d)所示。3种加速溶剂萃取条件下,1:1(V/V)的正己烷/二氯甲烷和1:1(V/V)的正己烷/丙酮萃取液的萃取效率均相对较高。考虑后续上样溶液为正己烷和二氯甲烷的混合,需要保持较高的非极性,所以选择了1:1(V/V)的正己烷/二氯甲烷作为加速萃取溶剂。
2.2 方法学考察 2.2.1 色谱和质谱条件分别将10 μg/mL的各OPFRs单标准溶液通过质谱直接进样,用于三重四极杆质谱MRM扫描条件的优化。9种OPFRs均可采用ESI+模式电离;选择各分子离子[M+H]+作为母离子,对其二级质谱条件进行优化。通过优化,可以保证MRM模式下被测离子对在质谱中具备较高的响应度。表 1显示了9种OPFRs优化后的母离子、子离子、锥孔电压和碰撞电压等重要的质谱参数。经过梯度洗脱条件的优化,各OPFRs可以在BEH C18色谱柱中得到完全分离,13 min内可完成检测。9种OPFRs在标准溶液中的总离子流图见图 2。

|
图 2 UPLC-MS-MS检测9种OPFRs的总离子流色谱图 |
通过甲醇稀释OPFRs混合标准溶液配置标准曲线。采用外标法进行定量分析,绘制的标准曲线在1~2 000 μg/L范围内呈良好的线性关系,相关系数R2 ≥ 0.995。
按照优化条件,用硅藻土代替组织样品,以检测样品提取、纯化、仪器分析过程中目标化合物的干扰(n=7),并确定该方法的检出限与测定下限。由于空白样品中均有各OPFRs的检出,计算7次平行空白测定的标准偏差,根据《环境监测分析方法标准制修订技术导则》(HJ 168—2010)附录A中的t值,以3.143倍的标准偏差确定方法检出限,并以4倍检出限作为测定下限。根据结果,按鲫鱼肌肉样品的平均脂含量计(2.9 ± 0.1)%,本方法的检出限(MLD)和测定下限(MLQ)范围分别为0.004~0.026和0.016~0.104 ng/g(以脂重计)(表 2)。本方法的检出限低于或接近于常用的分散固相萃取串联气相色谱技术[16-17] (MLD为0.01~9 ng/g,以脂重计)和碱性氧化铝滤芯的固相提取串联液相色谱技术[18] (MLD为0.35~6.37 ng/g,以脂重计)测定得到的检出限。
| 表 2 鱼类样品OPFRs分析方法的方法检出限、方法测定下限、平均基质效应、回收率、RSD及线性范围① |
质量控制样品(质量浓度为10 μg/L的混合标准溶液,n=6)在每批样品中都有运行,以确保分析的稳定性(即日间RSD %)(表 2)。OPFRs的相对标准偏差为1.6%~5.9 %。结果说明,该方法具有较低的检出限和较高的精密度。
2.2.3 基质效应和回收率基质效应和回收率实验通过鲫鱼肌肉组织样品加标进行测定。基质效应按照萃取后添加待测成分的方法进行测试,取鱼肉样品萃取、净化后的待测液(浓度为B),加入100 ng/g(干重)各OPFRs标液(浓度为A),按照公式Matrix effect =(A-B)/B×100%计算而得[19]。实验结果显示,除TPHP外,分析过程中OPFRs的回收率为77.2% ~108%。总体上,大多数目标物的基质效应<42.1%,特别是极性较强的TBOEP、TNBP、TCEP、TDCIPP和TCIPP,基质效应均<30%(表 2);而Log KOW值更高的EHDPHP(6.30)和TEHP(9.49)的基质效应反而比Log KOW值稍小的TPHP(4.70)和TCP(5.48)更低。鱼肉样品中OPFRs基质效应的产生是生物基质中内源性的物质与待测物的色谱共流出导致的;利用氨基柱的极性吸附力,可以去除大部分糖脂和类固醇等非极性的类脂物质,而磷脂类物质与OPFRs的结构类似,也具有一定的极性吸附力,可能会导致TPHP和TCP较高的基质效应。但总体来说,通过氨基柱的净化作用,大大降低了有机磷阻燃剂与鱼类样品中生物基质共洗脱的可能性。
2.3 鱼类样品测定采用本方法检测了广州市场中鲫鱼和北京市野生鲫鱼的肌肉中OPFRs的含量,结果见图 3。在2批鲫鱼样品中,9种OPFRs均有检出,质量比> 0.93 ng/g(以脂重计),说明OPFRs在这2个地区使用广泛并已分布于当地的水环境中。鲫鱼肌肉中主要的OPFRs为TNBP、TEHP、TCIPP和TCEP,其质量比为5.94~33.7 ng/g(以脂重计);总OPFRs含量与文献报道接近[20-21]。调查发现,北京市野生鲫鱼肌肉中总OPFRs含量略高于广州市养殖鲫鱼,但无明显差异(P>0.05)。污水处理厂再生水为北京市河流的重要供水来源,且OPFRs在污水处理厂中处理效率有限,会导致北京市河流鱼类具有较高的OPFRs暴露[20]。鱼类富集OPFRs的生态风险需要更多数据来证实。
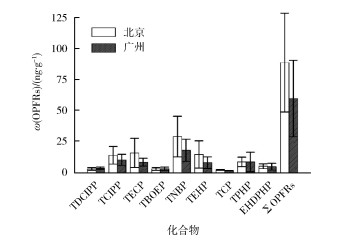
|
图 3 鲫鱼肌肉样品中OPFRs的质量比及分布情况(n=5) |
通过优化萃取、净化和液相色谱串联质谱条件,建立了一种氨基柱净化鱼类样品测定9种OPFRs的方法。该方法步骤简单、消耗溶剂少、净化效率高、检出限低、准确度高,可以实现对鱼类组织中多种有机磷阻燃剂的监测调查,可为深入研究该类污染物的生物富集、生态风险和健康评估提供强有力的方法参考。
| [1] |
VAN DER V I, DE BOER J. Phosphorus flame retardants: Properties, production, environmental occurrence, toxicity and analysis[J]. Chemosphere, 2012, 88(10): 1119-1153. DOI:10.1016/j.chemosphere.2012.03.067 |
| [2] |
WEI G L, LI D Q, ZHUO M N, et al. Organophosphorus flame retardants and plasticizers: Sources, occurrence, toxicity and human exposure[J]. Environmental Pollution, 2015, 196: 29-46. DOI:10.1016/j.envpol.2014.09.012 |
| [3] |
CAO S, ZENG X, SONG H, et al. Levels and distributions of organophosphate flame retardants and plasticizers in sediment from Taihu Lake, China[J]. Environmental Toxicology and Chemistry, 2012, 31(7): 1478-1484. DOI:10.1002/etc.1872 |
| [4] |
WANG R, TANG J, XIE Z, et al. Occurrence and spatial distribution of organophosphate ester flame retardants and plasticizers in 40 rivers draining into the Bohai Sea, north China[J]. Environmental Pollution, 2015, 198: 172-178. DOI:10.1016/j.envpol.2014.12.037 |
| [5] |
CHUNG H W, DING W H. Determination of organophosphate flame retardants in sediments by microwave-assisted extraction and gas chromatography-mass spectrometry with electron impact and chemical ionization[J]. Analytical and Bioanalytical Chemistry, 2009, 395(7): 2325-2334. DOI:10.1007/s00216-009-3139-4 |
| [6] |
HOU R, XU Y, WANG Z. Review of OPFRs in animals and humans: Absorption, bioaccumulation, metabolism, and internal exposure research[J]. Chemosphere, 2016, 153: 78-90. DOI:10.1016/j.chemosphere.2016.03.003 |
| [7] |
SANTIN G, ELJARRAT E, BARCELÓ D. Simultaneous determination of 16 organophosphorus flame retardants and plasticizers in fish by liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2016, 1441(C): 34-43. |
| [8] |
SUNDKVIST A M, OLOFSSON U, HAGLUND P. Organophosphorus flame retardants and plasticizers in marine and fresh water biota and in human milk[J]. Journal of Environmental Monitoring, 2010, 12(4): 943-951. DOI:10.1039/b921910b |
| [9] |
REEMTSMA T, QUINTANA J B, RODIL R, et al. Organophosphorus flame retardants and plasticizers in water and air I.Occurrence and fate[J]. Trac-Trends in Analytical Chemistry, 2008, 27(9): 727-737. DOI:10.1016/j.trac.2008.07.002 |
| [10] |
YAN X J, HE H, PENG Y, et al. Determination of organophosphorus flame retardants in surface water by solid phase extraction coupled with gas chromatography-mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2012, 40(11): 1693-1697. DOI:10.1016/S1872-2040(11)60586-0 |
| [11] |
刘祥萍, 范华锋, 李登昆. 饮用水中有机磷阻燃剂磷酸三(2-氯乙基)酯和磷酸三(2-氯丙基)酯残留的固相萃取-气相色谱火焰光度测定法[J]. 环境与健康杂志, 2015, 244(10): 65-67. |
| [12] |
李静, 王俊霞, 顾海东, 等. 超声提取-固相萃取-GC-MS/MS测定灰尘中10种有机磷阻燃剂[J]. 现代化工, 2018, 38(8): 239-244. |
| [13] |
李成辉, 朱芬芬, 张冬蕊, 等. 污泥中有机磷酸酯检测的预处理优化[J]. 中国环境科学, 2019, 39(1): 221-227. |
| [14] |
刘海萍, 杨素萍. 加压液体萃取技术在生物样品分析中的应用[J]. 河北北方学院学报(自然科学版), 2006, 22(5): 61-66. |
| [15] |
CHEN D, LETCHER R J, CHU S. Determination of non-halogenated, chlorinated and brominated organophosphate flame retardants in herring gull eggs based on liquid chromatography-tandem quadrupole mass spectrometry[J]. Journal of Chromatography A, 2012, 1220: 169-174. DOI:10.1016/j.chroma.2011.11.046 |
| [16] |
CAMPONE L, PICCINELLI A L, ÖSTMAN C, et al. Determination of organophosphorous flame retardants in fish tissues by matrix solid-phase dispersion and gas chromatography[J]. Analytical and Bioanalytical Chemistry, 2010, 397(2): 799-806. |
| [17] |
GAO Z, DENG Y, YUAN W, et al. Determination of organophosphorus flame retardants in fish by pressurized liquid extraction using aqueous solutions and solid-phase microextraction coupled with gas chromatography-flame photometric detector[J]. Journal of Chromatography A, 2014, 1366: 31-37. DOI:10.1016/j.chroma.2014.09.028 |
| [18] |
SANTIN G, ELJARRAT E, BARCELÓ D. Simultaneous determination of 16 organophosphorus flame retardants and plasticizers in fish by liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2016, 1441: 34-43. DOI:10.1016/j.chroma.2016.02.058 |
| [19] |
向平, 沈敏, 卓先义. 液相色谱-质谱分析中的基质效应[J]. 分析测试学报, 2009, 28(6): 753-756. |
| [20] |
HOU R, LIU C, GAO X, et al. Accumulation and distribution of organophosphate flame retardants (PFRs) and their di-alkyl phosphates (DAPs) metabolites in different freshwater fish from locations around Beijing, China[J]. Environmental Pollution, 2017, 229: 548-556. DOI:10.1016/j.envpol.2017.06.097 |
| [21] |
LIU Y E, LUO X J, ZAPATA C P, et al. Organophosphorus flame retardants in a typical freshwater food web: Bioaccumulation factors, tissue distribution, and trophic transfer[J]. Environmental Pollution, 2019, 255: 113286. DOI:10.1016/j.envpol.2019.113286 |
 2020, Vol. 12
2020, Vol. 12 

