小分子有机污染物指分子质量小(<1 kD)、对人体健康和生态环境具有危害作用的有机化合物,包括持久性有机污染物(POPs)、内分泌干扰物、农兽药残留物等[1-2]。小分子有机污染物在环境中分布广泛,在极低浓度下具备致癌、致畸、致突变性和内分泌干扰等作用[3-5]。现有的检测仪器包括高效液相色谱仪、气相色谱-质谱联用仪等大型设备[4-6]。虽然这些技术具有灵敏度高、准确性强等优点,但其仪器昂贵、程序复杂、检测成本高,难以实现小分子有机污染物的现场即时检测[7-8]。特别是污染事件中的一些小分子有机污染物,不能对其进行快速的定性、定量检测,无法及时提供污染信息,难以抵御事故风险,保障国家水环境安全。
化学发光免疫分析法是将化学发光原理和免疫分析原理有机结合的新型分析技术,既具备化学发光反应的高灵敏性,又具有生物亲和反应的高特异性[7-10]。然而,要使化学发光生物传感器真正发挥现场即时定量检测的功能,仪器的小型化和便携化是一大挑战。虽然化学发光无须激发光源,原理上很容易实现小型化,但现有的商业化化学发光检测仪往往体积较大、价格昂贵,不适用于微量和痕量物质的现场快速定量检测[6-7]。原因之一是现在大部分化学发光检测仪都采用光电倍增管进行化学发光信号检测。然而,光电倍增管具有体积大、价格昂贵、高压工作、易碎和易受电磁干扰的缺点,很难实现化学发光检测仪的小型化和便携化。另一方面,化学发光免疫分析技术需要将与目标物结合的生物识别探针与未结合的生物识别探针进行高效分离,以实现目标物的定量检测。为此,现有化学发光免疫分析技术常利用功能化磁珠进行分离,这不仅导致检测程序复杂化,检测重复性和可靠性差,而且不利于仪器的小型化和传感器再生,导致检测成本较高[8-10]。因此,发展新型分离与检测一体化技术是发展用于小分子有机污染物化学发光免疫分析技术的核心。
现融合化学发光、生物亲和反应和光纤生物传感原理,设计了一种新型化学发光光纤免疫传感分析仪。该仪器使用的光纤可同时作为生物传感和化学发光光信号传输元件,并利用自主研发的微型高灵敏光电二极管检测光信号,有效提高了系统光传递效率和信噪比,降低了光损耗,极大地减少了光学分离元件,使其结构简单和紧凑。现以双酚A(BPA)为例,发展了基于化学发光免疫分析原理的小分子有机污染物现场快速灵敏检测技术。BPA是一种非常重要的小分子有机化工原料,不仅用于聚碳酸酯、聚砜树脂、增塑剂、抗氧剂等一系列化工产品的生产,也是用于制造婴儿奶瓶、水瓶和其他食品容器的关键物质[11-14]。BPA目前已在环境中广泛存在,在奶瓶和桶装水中时有检出。BPA作为一种典型的内分泌干扰物,不仅会导致生殖障碍,而且有可能引发各种癌症,如前列腺癌、睾丸癌和乳腺癌等[13, 15-20]。现有的BPA检测手段主要采用高效液相色谱仪(HPLC)、气相色谱-质谱联用仪(GC-MS)等大型仪器,具有操作复杂、检测周期长、成本高、难以适用于现场检测的缺点。因此,发展用于双酚A的高灵敏度、高特异性、现场快速检测的新技术显得尤为重要[9, 15-16]。为此,结合间接竞争免疫反应原理,建立了BPA现场快速检测的化学发光免疫分析新方法,并用于实际水样的检测。
1 材料与方法 1.1 仪器与试剂仪器:SBL-108DT超声波清洗仪(宁波新芝生物科技股份有限公司);TLYCS-30AF恒温振荡器(江苏天翎仪器有限公司);DHG-9030恒温干燥箱(浙江明德仪器有限公司)。
试剂:惰性蛋白卵清蛋白(OVA)偶联的包被抗原(BPA-OVA)、抗-BPA抗体(Anti-BPA antibody)、阿特拉津(ATZ)抗体(Anti-ATZ antibody)、微囊藻毒素-LR(MC-LR)抗体(Anti-MC-LR antibody)均购自金达清创环保有限公司(北京);BPA标准品购自北京坛墨质检有限公司;牛血清蛋白(BSA)、N-琥珀酰亚胺基-4-马来酰亚胺-丁酸酯(GMBS)、3-巯基丙基三甲氧基硅烷(MTS)、十二烷基磺酸钠(SDS)、叠氮化钠(NaN3)、双酚F(BPF)、苯酚、2,4-滴(2,4-D)均购自美国Sigma公司;辣根过氧化物酶(HRP)标记的羊抗小鼠抗体(HRP-二抗)购自美国赛默飞公司;3-氨基邻苯二甲酸二甲酯(3-aminohpthalate)、鲁米诺化学发光底物均购自上海翊圣生物科技有限公司;氮气、乙醇、浓硫酸、甲苯、氯化钠、氯化钾均购自北京化学公司。实验过程中全部使用去离子水配制试剂。
1.2 光纤探头的制备功能化光纤探头的制备见图 1。
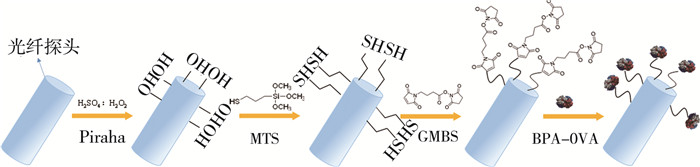
|
图 1 功能化光纤探头的制备示意 |
(1) 用刀片将长5.0 cm光纤探头(直径600 μm)的涂覆层去除,配制Piraha溶液[V(浓硫酸) ∶ V(H2O2)=3 ∶ 1],将清洗干净的光纤探头浸入其中,在室温下反应30 min,在光纤表面形成功能化羟基。而后用超纯水清洗干净,放入温度为105 ℃的干燥箱中烘干。
(2) 将羟基化后的光纤探头放入2% 的MTS的甲苯溶液中,在室温反应2 h后用甲苯清洗3次,去除表面未反应的MTS,氮气吹干后在120 ℃干燥箱中干燥1 h,光纤探头形成功能化巯基。
(3) 将光纤探头放入双功能试剂GMBS(2 mmol/L)乙醇溶液中反应1 h,然后用乙醇清洗干净。
(4) 将光纤探头放入1.5 g/L的BPA-OVA包被抗原溶液中反应过夜,光纤表面偶联BPA-OVA。
(5) BPA-OVA功能化光纤探头用超纯水冲洗干净后,放入2 g/L的BSA溶液封闭非特异性吸附位点。
1.3 化学发光光纤免疫传感分析仪化学发光光纤免疫传感分析仪主要包括光路系统、流动进样系统和信号处理与控制系统(图 2)。在光路系统中,功能化光纤探头既可作为目标物分析的免疫传感反应界面,又可作为结合生物分子与未结合生物分子的分离元件,以及化学发光信号的收集器。这样不仅可以极大地简化化学发光免疫分析仪的系统结构,免除磁珠分离过程,而且可以有效地提高分析仪的检测灵敏度。光纤探头收集的化学发光信号经光纤跳线传输后,由自主研制的高灵敏光电探测器检测,并将光信号转化为电信号,以便于后续处理。流动进样由蠕动泵、六通阀、微流控样品池组成。各种试剂与样品由程序控制顺序进入样品池。信号处理与控制系统用于化学发光信号处理以及免疫分析仪的控制。
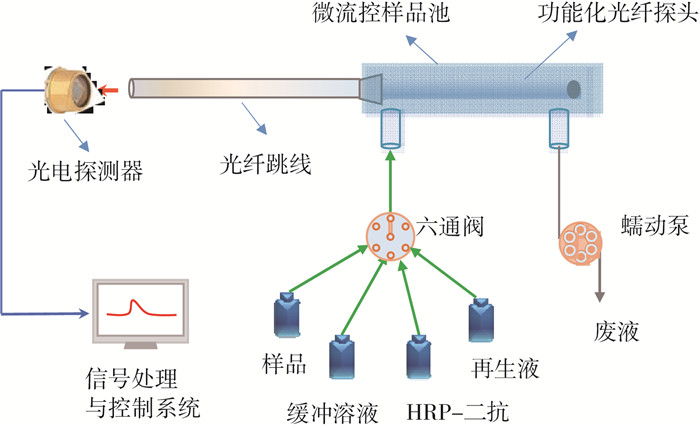
|
图 2 化学发光光纤免疫传感分析仪结构示意 |
为了评估典型基质的实际水样对BPA化学发光免疫传感分析的影响,进行了加标回收实验。实际水样为实验室自来水、某品牌矿泉水和二沉池出水。每种水样的加标质量浓度为30.0和70.0 μg/L,利用检测到的化学发光信号值和标准曲线,获得样品中的BPA测定值。
2 结果与讨论 2.1 BPA检测原理与检测过程基于化学发光免疫分析机制的BPA检测原理见图 3,典型检测过程与信号轨迹见图 4。抗-BPA抗体质量浓度为0.5 μg/mL,HRP-二抗质量浓度为5.0 μg/mL。
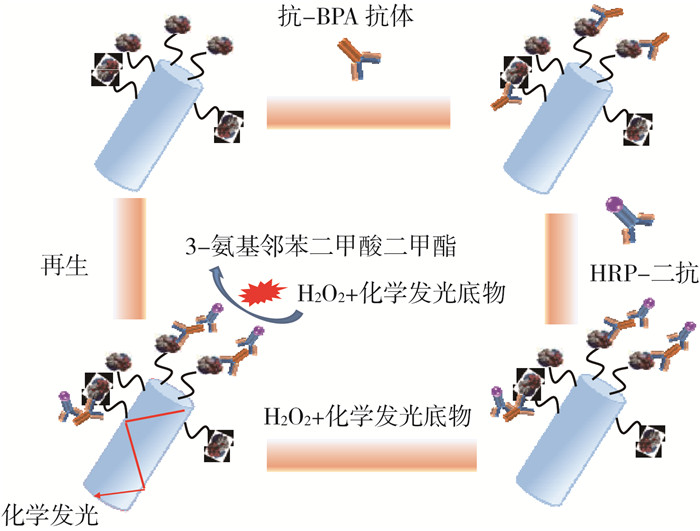
|
图 3 基于化学发光免疫分析机制的BPA检测原理 |
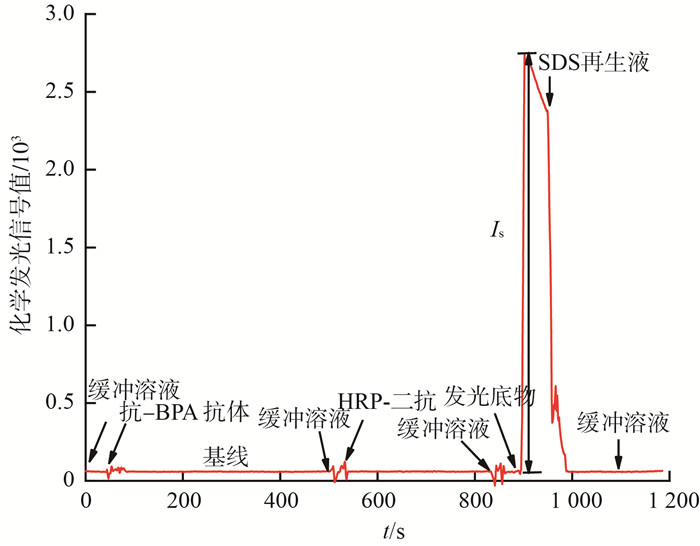
|
图 4 典型检测过程与信号轨迹 |
先将BPA-OVA功能化光纤探头置入微流控样品池。然后,将一定体积样品与抗-BPA抗体混合反应,样品中BPA与部分抗体结合。反应一段时间后,混合物通入样品池,仍含有自由亲和位点的抗体与功能化光纤探头表面的包被抗原结合。使用缓冲溶液清洗多余抗体后,通入一定质量浓度的HRP-二抗,二抗与结合到光纤探头的抗-BPA抗体反应。反应一定时间后,使用缓冲溶液清洗多余二抗。通入发光底物,分析仪检测到1个突然上升的发光信号。利用发光信号强度与BPA样品的线性关系,即可实现BPA的定量检测。为实现光纤探头的再生利用,使用SDS再生液将结合到光纤探头表面的一抗和二抗去除,检测信号回到基线。检测信号的有效值(Is)为化学发光光纤免疫传感分析仪检测到的信号最大值与基线值之差。
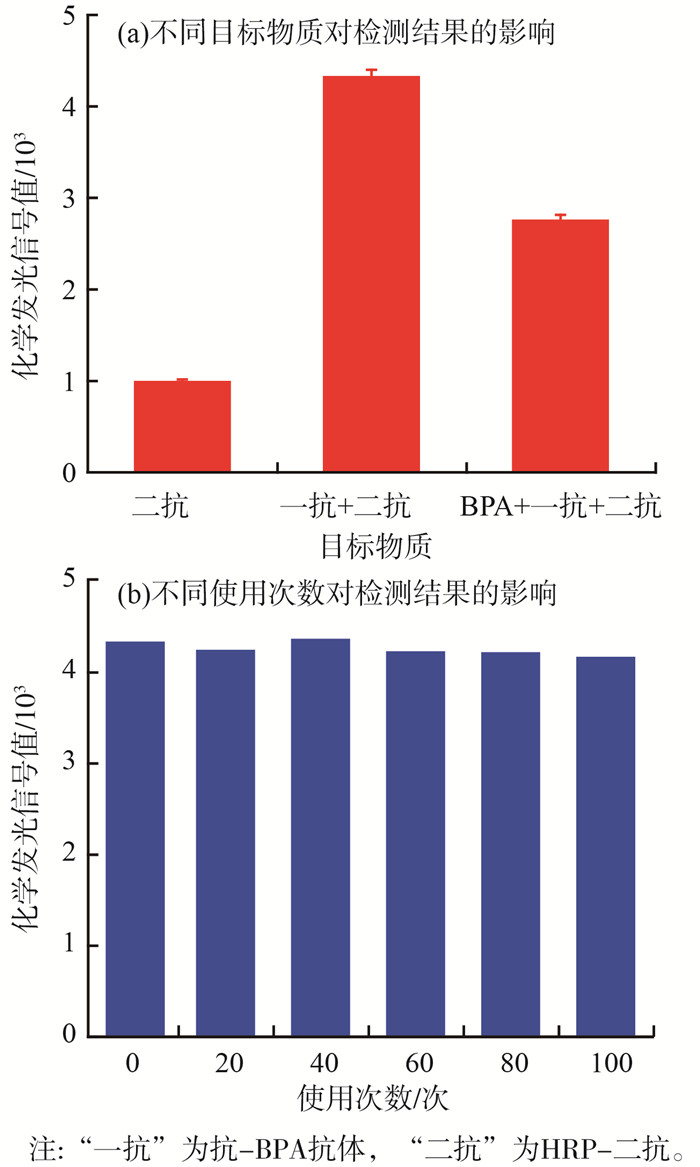
2.2 功能化光纤探头的性能表征为验证BPA-OVA成功修饰到光纤探头表面,进行了几组对照实验,功能化光纤探头的性能表征见图 5(a)(b),抗-BPA抗体质量浓度为0.5 μg/mL,HRP-二抗质量浓度为5.0 μg/mL。
|
图 5 功能化光纤探头的性能表征 |
首先,直接将HRP-二抗加入微流控样品池,反应后使用缓冲溶液清洗,再将化学发光底物通入样品池,仪器检测到化学发光信号值仅为985,这是由于部分HRP-二抗的非特异性吸附导致的。其次,将抗-BPA抗体和HRP-二抗依次通入样品池并反应,使用缓冲溶液冲洗后,将化学发光底物加入样品池,仪器检测到其信号值(4 321)远高于前1组实验。这是由于抗-BPA抗体特异性结合到BPA-OVA修饰的光纤探头上,然后HRP-二抗特异性结合到抗-BPA抗体,催化底物化学发光而导致的。再次,将抗-BPA抗体、0.5 μg/mL的BPA混合反应物和HRP-二抗依次通入样品池并反应,使用缓冲溶液冲洗后,将化学发光底物加入样品池,仪器检测信号值为2 758,高于第1组但低于第2组的信号值。这是由于加入的BPA与抗-BPA抗体特异性结合并占据部分亲和位点,导致结合到光纤探头的抗-BPA抗体减少所致。实验结果表明,BPA-OVA成功修饰到光纤探头表面,且化学发光信号主要来自抗体抗原的特异性亲和反应。因此,功能化光纤探头可以用于BPA的定量检测。
为验证BPA-OVA功能化光纤探头的可再生性能,使用抗-BPA抗体和HRP-二抗进行多次重复实验。实验结果表明,功能化光纤探头重复使用100次后,其化学发光信号值没有明显下降。这表明功能化光纤探头具有良好的可再生性能,这不仅可以有效提高检测的准确性,而且可以大幅度降低检测成本。
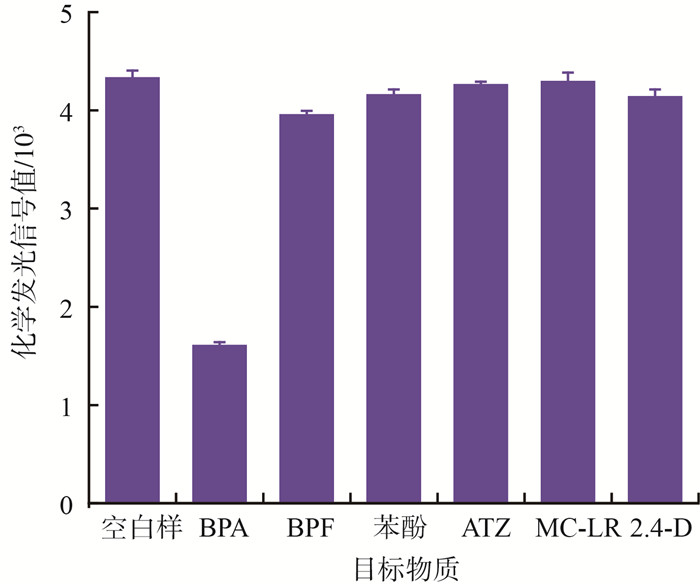
2.3 选择性评价由于水环境中存在多种小分子有机污染物,为提高分析准确性,考察抗-BPA抗体对BPA的选择性是评价检测方法的重要指标[17-18]。将ATZ、BPF、苯酚、2,4-D、MC-LR这5种小分子有机污染物分别与抗-BPA抗体等体积混合,污染物最终质量浓度为100 μg/mL。然后按BPA检测方法的程序进行检测,选择性测试结果见图 6。抗-BPA抗体质量浓度为0.5 μg/mL,HRP-二抗质量浓度为5.0 μg/mL。
|
图 6 选择性测试结果 |
由图 6可见,ATZ、苯酚、2,4-D、MC-LR这4种污染物所对应的化学发光信号值与空白对照组的信号值相比没有明显下降。虽然BPF的加入使得化学发光信号值略有下降,但比加入BPA导致的化学发光信号下降值少很多,这说明所建立的方法对BPA检测具有良好的选择性,5种污染物的存在不会对BPA检测产生明显影响。
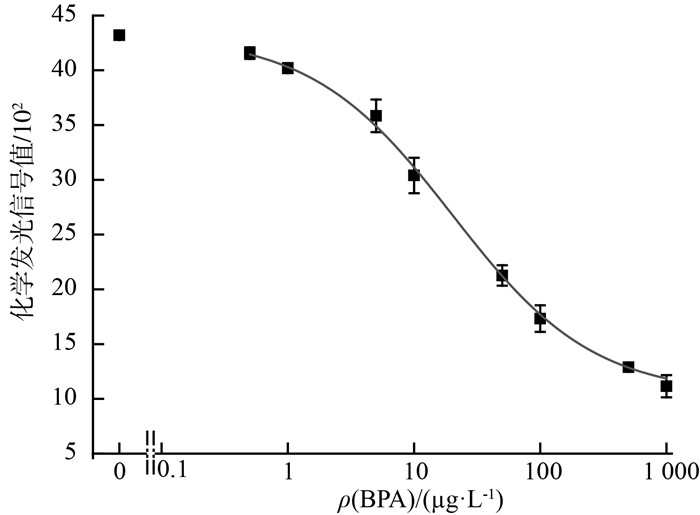
2.4 BPA检测标准曲线的绘制为获得基于化学发光光纤免疫传感分析原理的BPA检测标准曲线,配制不同质量浓度的BPA溶液,分别与0.5 μg/mL的抗-BPA抗体混合,预反应5 min后输入样品检测池。在检测池继续反应7.5 min后,使用缓冲溶液冲洗去除未结合的抗-BPA抗体。然后,通入质量浓度为5.0 μg/mL的HRP-二抗反应6 min。使用缓冲溶液冲洗去除未结合的HRP-二抗后,再加入化学发光底物,立即检测化学发光信号值。各个质量浓度重复测试3次,化学发光信号值的标准偏差都<5%,表明该方法具有良好的稳定性。利用四参数logistics模型,将不同质量浓度下的化学发光信号值进行拟合,得到BPA的检测标准曲线,见图 7。
|
图 7 化学发光光纤免疫传感分析仪检测BPA的标准曲线 |
由图 7可见,BPA线性检测范围为0.95~100.9 μg/L,根据空白样值的3倍标准偏差,可得检测限为0.15 μg/L。
2.5 实际样品的检测为验证方法在实际水样中应用的可行性,使用该方法对校园景观水、自来水和地表水这3种实际水样进行加标回收实验。3种水样的pH值为7.0~7.3,ρ(总有机碳)分别为14.2,5.6和11.8 mg/L,3种水样未加标前的检测值均低于方法检测限,视为未检出。实际水样加标回收实验结果见表 1。由表 1可见,3种水样加标回收率为94.5%~116.0%,3次平行实验的标准偏差均<10%。因此,该方法可以用于实际水样中BPA的现场快速检测,水体基质对免疫分析的影响较少。
| 表 1 实际水样加标回收实验结果(n=3) |
基于化学发光光纤免疫传感分析仪和间接竞争免疫竞争分析原理,建立了BPA的定量检测方法。结果表明,功能化光纤具有良好的可再生性,可以重复使用100次以上。BPA线性检测范围为0.95~100.9 μg/L,检测限为0.15 μg/L。实际水样加标回收实验表明,该方法加标回收率为94.5%~116.0%,标准偏差<10%,说明方法具有很好的精密度和准确度,能够用于实际水样中BPA的检测。同理,利用其他小分子有机污染物包被抗原功能化的光纤探头和相应的荧光标记抗体,化学发光光纤免疫传感分析仪可以用于其他小分子有机污染物的现场快速检测。
| [1] |
CARVALHO I T, SANTOS L. Antibiotics in the aquatic environments: A review of the European scenario[J]. Environment International, 2016, 94: 736-757. DOI:10.1016/j.envint.2016.06.025 |
| [2] |
于杰, 周静, 江澜, 等. 高效液相色谱荧光法测定食品包装材料中双酚A及双酚S的迁移量[J]. 粮食与食品工业, 2017, 24(3): 61-64, 70. |
| [3] |
封跃鹏, 房丽萍, 邱赫男, 等. 便携式气相色谱质谱测定水中挥发性有机物再现性和准确度研究[J]. 中国环境监测, 2013, 29(6): 117-122. |
| [4] |
GUO M M, HE M F, ZHONG J J, et al. High-performance liquid chromatography (HPLC)-fluorescence method for determination of bisphenol A diglycidyl ether (BADGE) and its derivatives in canned foods[J]. Science of the Total Environment, 2019, 710: 134975-134982. |
| [5] |
王玉祥, 丁金美, 杨文武, 等. 突发性水环境应急监测中快速定性未知有机污染物及案例分析[J]. 环境监控与预警, 2019, 11(3): 23-26. DOI:10.3969/j.issn.1674-6732.2019.03.005 |
| [6] |
IRANIFAM M. Analytical applications of chemiluminescence systems assisted by carbon nanostructures[J]. Trends in Analytical Chemistry, 2016, 80: 387-415. DOI:10.1016/j.trac.2015.08.018 |
| [7] |
ZHANG C, LIU Z, LI Y, et al. High sensitivity chemiluminescence enzyme immunoassay for detecting staphylococcal enterotoxin A in multi-matrices[J]. Analytica Chemica Acta, 2013, 796: 14-19. DOI:10.1016/j.aca.2013.07.044 |
| [8] |
ZHANG Z. Peroxidase-catalyzed chemiluminescence system and its application in immunoassay[J]. Talanta, 2018, 180: 260-270. DOI:10.1016/j.talanta.2017.12.024 |
| [9] |
LIU L R, LIU L Q, CHEN X Q, et al. Development of ahighly sensitive chemiluminescence enzyme immunoassay for the determination of Bisphenol A[J]. Advanced Materials Research, 2013, 726-731: 1283-1286. DOI:10.4028/www.scientific.net/AMR.726-731.1283 |
| [10] |
VERDIAN A, FOOLADI E, ROUHBAKHSH Z. Recent progress in the development of recognition bioelements for polychlorinated biphenyls detection: Antibodies and Aptamers[J]. Talanta, 2019, 202: 123-135. DOI:10.1016/j.talanta.2019.04.059 |
| [11] |
KANG J H, KONDO F, KATAYAMA Y. Human exposure to Bisphenol A[J]. Toxicology, 2006, 226(2-3): 79-89. |
| [12] |
CORRALES J, KRISTOFCO L A, STEELE W B, et al. Global assessment of Bisphenol A in the environment: Review and analysis of its occurrence and bioaccumulation[J]. Dose Response, 2015, 13(3): 1-29. |
| [13] |
MIAO W, WEI B, YANG R, et al. Highly specific and sensitive detection of bisphenol A in water samples using an enzyme-linked immunosorbent assay employing a novel synthetic antigen[J]. New Journal of Chemistry, 2014, 38(2): 669-675. |
| [14] |
MORENO M J, D'ARIENZO P, MANCLUS J J, et al. Development of monoclonal antibody-based immunoassays for the analysis of bisphenol A in canned vegetables[J]. Journal of Environmental Science and Health Part B, 2011, 46(6): 509-517. |
| [15] |
LONG F, ZHU A, ZHOU X, et al. Highly sensitive and selective optofluidic-based immunosensor for rapid assessment of Bisphenol A leaching risk[J]. Biosensors and Bioelectronics, 2014, 55: 19-25. |
| [16] |
TAJIK S, BEITOLLAHI H, NEJAD F G, et al. Recent advances in electrochemical sensors and biosensors for detecting Bisphenol A[J]. Sensors, 2020, 20(12): 3364. |
| [17] |
YANG Y, LIU S, SHI P, et al. A highly sensitive and selective label-free electrochemical biosensor with a wide range of applications for Bisphenol A detection[J]. Electroanalysis, 2021, 33: 1-10. |
| [18] |
WU L, LU X, NIU K, et al. Tyrosinase nanocapsule based nano-biosensor for ultrasensitive and rapid detection of bisphenol A with excellent stability in different application scenarios[J]. Biosensors and Bioelectronics, 2020, 165: 112407. |
| [19] |
VERMA D, YADAV A K, RATHEE G, et al. Review-prospects of nanomaterial-based biosensors: A smart approach for Bisphenol-A detection in Dental Sealants[J]. Journal of the Electrochemical Society, 2022, 169(2): 027516. |
| [20] |
LI M, HU L, NIU C, et al. A magnetic separation fluorescent aptasensor for highly sensitive detection of Bisphenol A[J]. Sensor Actuators B: Chemical, 2018, 266: 805-811. |
 2023, Vol. 15
2023, Vol. 15 