亚硫酸盐是一种被广泛使用的食品添加剂和防腐剂,人体若长期过量摄入亚硫酸盐,会引发过敏反应,从而造成呼吸困难[1-6]。亚硫酸盐的另一个副作用是与钙结合,导致人体钙质流失,因而准确测定环境中的亚硫酸盐浓度是非常必要的。亚硫酸盐的测定主要有滴定法、比色法、离子色谱法等[7]。其中滴定法和比色法的操作过程复杂,人为影响因素多,需要消耗较多试剂,且可测定的目标离子种类单一。离子色谱法消耗试剂少,仪器稳定性好,可减少操作过程带来的误差,且能同时测定多种阴离子,目前已成为阴离子测定的首选方法[8-14]。
环境保护行业标准《水质无机阴离子(F-、Cl-、NO2-、Br-、NO3-、PO43-、SO32-、SO42-)的测定离子色谱法》(HJ 84—2016)中采用离子色谱法测定亚硫酸根,用碳酸盐体系测定时,由于亚硫酸根容易氧化且与硫酸根保留时间接近,分析实际样品时存在分离效果不理想的现象,尤其是当亚硫酸根离子浓度较高时,对测定结果的准确度有较大影响。因此,有效分离亚硫酸根和硫酸根对准确测定亚硫酸根浓度十分必要。现采用碳酸盐体系测定水中亚硫酸根,探讨了亚硫酸根溶液的稳定性,优化了淋洗液的配比,以实现有效分离亚硫酸根和硫酸根的目的。
1 实验部分 1.1 仪器与试剂仪器:Metrohm 930 Compact IC Flex离子色谱仪,配电导检测器、化学抑制器、在线自动配标单元、在线超滤单元;Metrohm-919自动进样器;Metrosep A Supp 5-150/4.0阴离子色谱柱;Metrosep A Supp 4/5 Guard保护柱。以上均购自瑞士万通公司。
试剂:亚硫酸根标准贮备液(1 000 mg/L,B21070383,坛墨质检科技股份有限公司);丙酮(纯度≥99.8%,德国默克公司);亚硫酸根标准物质[(14.1±1.0) mg/L,B2006129,坛墨质检科技股份有限公司];无水碳酸钠、碳酸氢钠(分析纯,国药集团化学试剂有限公司);实验用水(不含目标化合物的去离子水)。
1.2 色谱条件淋洗液:碳酸钠(Na2CO3,3.2 mmol/L)、碳酸氢钠(NaHCO3,1.0 mmol/L)、丙酮(CH3COCH3,5%)混合溶液;抑制器再生液:硫酸溶液(H2SO4,0.5%);流量:0.7 mL/min;色谱柱柱温:30 ℃;进样体积:10 μL。
1.3 样品前处理使用针筒过滤器进行样品前处理时,水样直接进入分析系统有可能堵塞进样阀和色谱柱,细菌也可能在系统中滋生。现使用在线超滤技术处理样品,无须采用针筒滤头过滤,可减少交叉污染问题,且滤头消耗较少,操作简单,尤其适合大批量样品的分析,能够明显提高工作效率。
1.4 溶液配制亚硫酸根标准使用液(50.0 mg/L):移取5.00 mL亚硫酸根标准贮备液,用水稀释定容至100 mL。
亚硫酸根系列标准溶液:吸取50.0 mg/L亚硫酸根标准使用液,利用在线自动配标单元,配制成质量浓度分别为0,0.500,1.00,2.50,5.00和10.0 mg/L的标准系列。
1.5 碳酸盐淋洗液准确称取0.339 2 g的Na2CO3和0.084 0 g的NaHCO3,分别溶于适量水中,转入1 000 mL容量瓶,于容量瓶内加入50 mL的CH3COCH3,用水定容至标线,混匀。溶液中c(Na2CO3)=3.2 mmol/L,c(NaHCO3)=1.0 mmol/L,φ(CH3COCH3)=5.0%。
2 结果与讨论 2.1 色谱柱的选择常见的阴离子色谱柱有Metrosep A Supp 5 - 150、Metrosep A Supp 5 - 250、Metrosep A Supp 7 - 250和Metrosep A Supp 10 - 75色谱柱等。Metrosep A Supp 7 - 250色谱柱需要的分离时间较长,Metrosep A Supp 10 - 75色谱柱可进行常规阴离子测定,但不适合氟离子(F-)分析,而常规阴离子分析时通常需要进行F-分析,因此Metrosep A Supp 5 - 150和Metrosep A Supp 5 - 250色谱柱更具备通用性,这2种色谱柱填料相同,柱长不同。实验发现,Metrosep A Supp 5 - 150和Metrosep A Supp 5 - 250均能满足亚硫酸根与硫酸根的分离要求,完成常见阴离子分析的分离时间分别约为15和24 min,色谱图见图 1(a)(b)。综合考虑,选用分离时间较短的Metrosep A Supp 5 - 150色谱柱。
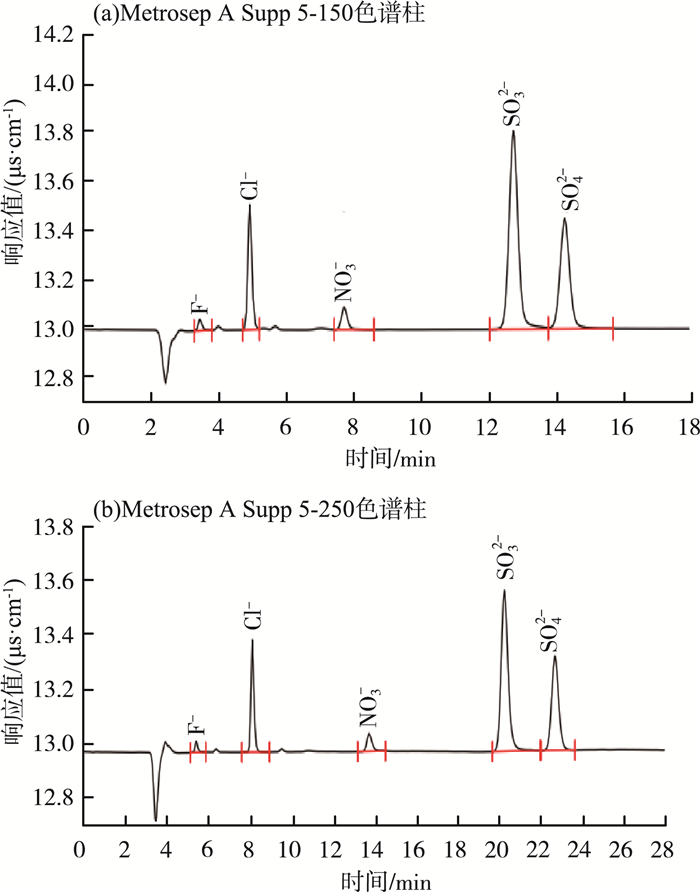
|
图 1 Metrosep A Supp 5 - 150和Metrosep A Supp 5 - 250色谱柱的分离色谱图 |
由于亚硫酸根溶液的化学性质不稳定,容易转化为硫酸根,给保存带来了极大的不便。分别用纯水、甲醛水溶液为介质,用固体亚硫酸钠配制10.0 mg/L的亚硫酸根标准溶液,于25 ℃下放置24 h后测定质量浓度,考察溶液的稳定性,结果见表 1。由表 1可见,纯水配制的亚硫酸根标准溶液,放置24 h后,亚硫酸根质量浓度大幅下降,降幅为33%,同时硫酸根增加了2.4 mg/L,表明在纯水介质中,亚硫酸根溶液不稳定,容易转化为硫酸根。在0.05%的甲醛介质中亚硫酸根溶液较稳定,24 h内无显著变化,可见甲醛有利于亚硫酸根溶液的保存。
| 表 1 亚硫酸根在不同介质中放置24 h后的测定结果① |
在10.0 mg/L的亚硫酸根溶液中添加甲醛,甲醛的体积分数分别为0%,0.01%,0.02%,0.05%,0.10%和0.20%,放置24 h后,测定回收率,结果见图 2。由图 2可见,亚硫酸盐的质量浓度在0~10.0 mg/L范围内,甲醛体积分数的增加,有利于提升亚硫酸根的稳定性。甲醛体积分数为0.05%时,回收率为102%,表明亚硫酸根无明显转化,稳定效果较好;甲醛体积分数>0.05%时,回收率呈下降趋势;甲醛体积分数为0.20%时,回收率降至62.8%。因此在亚硫酸根溶液中加入体积分数为0.05%的甲醛,可有效增加溶液的稳定性。
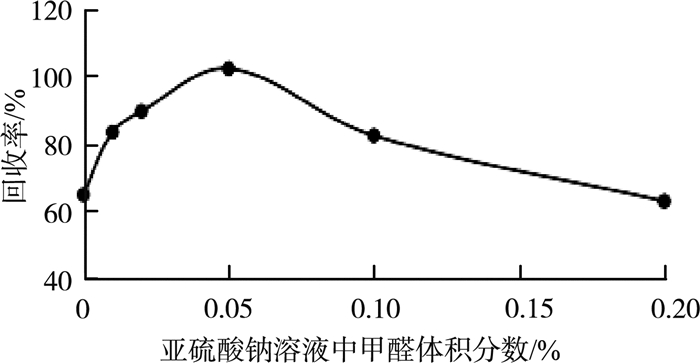
|
图 2 不同体积分数的甲醛对亚硫酸钠溶液回收率的影响 |
以体积分数为0.05%的甲醛水溶液为介质,配制10.0 mg/L的亚硫酸根溶液,于4 ℃下冷藏保存,每隔一段时间测定亚硫酸根的回收率,考察其保持稳定的最佳时长,结果见图 3。由图 3可见,亚硫酸根溶液放置19 d,回收率保持在98%以上,之后呈下降趋势,21 d后降为83.2%。因此体积分数为0.05%的甲醛水溶液配制的亚硫酸根溶液,在4 ℃下冷藏可保存19 d。
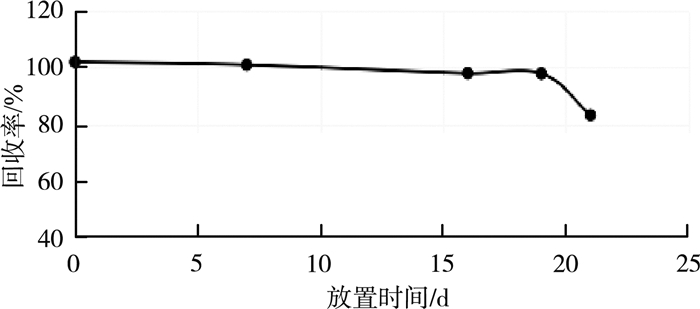
|
图 3 不同放置时长对亚硫酸钠溶液回收率的影响 |
采用常规阴离子淋洗液(3.2 mmol/L的Na2CO3+1.0 mmol/L的NaHCO3)进行分析时,亚硫酸根和硫酸根出峰时间非常接近。有机改进剂可以调节离子交换过程的选择性,改变分离柱对目标物的保留特性。丙酮作为常见的有机改进剂,可改变保留时间,改善峰形,有效调节亚硫酸根和硫酸根的分离度。在淋洗液中分别加入体积分数为0%,5%和10%的丙酮,对同一质量浓度的混合标准溶液进行分析,不同丙酮体积分数对亚硫酸根和硫酸根分离度的影响见图 4(a)—(c)。

|
图 4 不同丙酮体积分数对亚硫酸根和硫酸根分离度的影响 |
由图 4可见,当丙酮体积分数为0%时,亚硫酸根与硫酸根互相干扰,难以完全分离,样品中亚硫酸根质量浓度较高,硫酸根质量浓度较低;当丙酮体积分数为5%和10%时,亚硫酸根与硫酸根均可以完全分离,分离度>3.0,满足分离要求。随着有机改进剂体积分数的增加,亚硫酸根和硫酸根保留时间缩短,但柱压升高(分别为7.09,7.71和8.50 MPa),峰高、峰面积减小,灵敏度降低。结合目标物分离度、色谱柱使用寿命、试剂毒性等方面综合考虑,选取淋洗液为3.2 mmol/L的Na2CO3+1.0 mmol/L的NaHCO3+5.0%的丙酮混合溶液。
2.4 标准曲线与方法检出限按照1.2节色谱条件对亚硫酸根系列标准溶液进行测定,峰面积测定结果见图 5。以亚硫酸根的质量浓度x为横坐标,色谱峰面积y为纵坐标进行线性回归,计算得线性回归方程为y=2.40×10-2x+0.001,相关系数(r)=0.999 8。结果表明,当水样中亚硫酸根的质量浓度为0~10.0 mg/L时,线性关系良好。
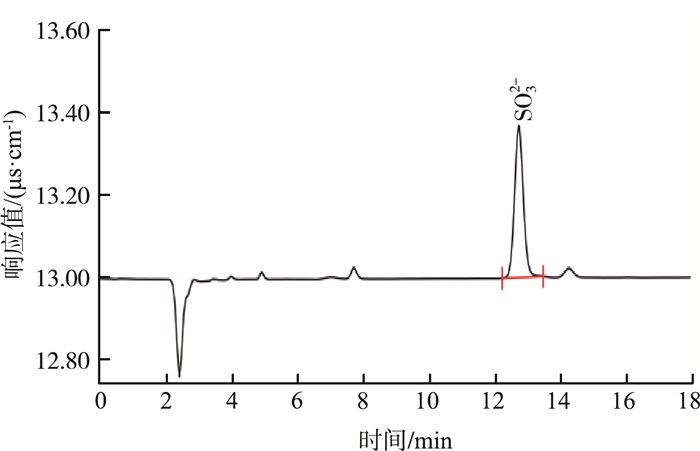
|
图 5 5.00 mg/L亚硫酸根标准溶液色谱图 |
在空白水样中加入估计检出限3~5倍的亚硫酸根标准溶液,即加入0.150 mg/L的亚硫酸根标准溶液,重复测定7次,计算测定值的标准偏差(S)。由单侧t分布表查得,当置信水平为99%时,自由度f=n-1=6,t=3.143。根据检出限计算公式MDL=S×t(n-1,0.01),计算得到检出限[15]。当进样体积为10 μL时,亚硫酸根检出限为0.034 mg/L。
2.5 正确度及精密度分别对亚硫酸根质量浓度为0.500和5.00 mg/L的标准溶液以及质量浓度为(14.1±1.0) mg/L的亚硫酸根标准物质进行测定,每种质量浓度重复测定6次,结果见表 2。由表 2可见,测定结果的相对标准偏差(RSD)为1.5%~2.5%,相对误差为0.4%~2.1%,说明该方法具有较高的正确度和精密度。
| 表 2 正确度及精密度测定结果(n=6) |
分别在2个实际水样中进行不同质量浓度的加标回收实验,每种加标量平行测定6次,结果见表 3。由表 3可见,加标回收率为96.8%~103%,加标样品测定结果的RSD为2.4%~4.7%,该方法在测定实际样品时能很好地进行亚硫酸根和硫酸根分离,不影响其他常规阴离子的测定,准确度较高。
| 表 3 实际样品测定结果(n=6)① |
对离子色谱法测定水中亚硫酸根方法进行了探讨和优化,选择Metrosep A Supp 5 - 150色谱柱,亚硫酸根溶液加入0.05%的甲醛,碳酸盐淋洗液调整为3.2 mmol/L的Na2CO3+1.0 mmol/L的NaHCO3+5.0%的丙酮混合溶液。经离子色谱检测,优化后亚硫酸根与硫酸根分离情况良好,方法检出限为0.034 mg/L,标准样品测定的RSD为1.5%~2.5%,相对误差为0.4%~2.1%,实际样品的RSD为2.4%~4.7%,回收率为96.8%~103%。该方法灵敏度好、精密度高、正确度好、操作简便,适用于水中亚硫酸根的测定。
| [1] |
王永根, 王剑波, 包玲月, 等. 在线渗析-离子色谱法测定食品亚硫酸盐含量研究[J]. 预防医学, 2017, 29(1): 44-48. |
| [2] |
宋莲芳. 食品中亚硫酸盐的离子色谱法测定分析[J]. 生物技术世界, 2016(2): 57. |
| [3] |
李小蕾, 刘文琴, 黄冬梅, 等. 离子色谱法测定虾蟹肉中亚硫酸盐残留量[J]. 理化检验(化学分册), 2013, 49(3): 310-312, 315. |
| [4] |
褚红英. 离子色谱法对食品中亚硫酸盐含量的测定[J]. 食品安全导刊, 2018(24): 92. |
| [5] |
党卫红, 徐启红. 亚硫酸盐在食品加工中的应用[J]. 食品工程, 2008(3): 22-25. |
| [6] |
姜川, 唐旭伟, 张夏翊, 等. 离子色谱法测定燕窝中的亚硫酸盐[J]. 分析仪器, 2019(1): 114-116. |
| [7] |
郭晓艳, 罗晓, 宋卫得, 等. 快速蒸馏-离子色谱法测定干红葡萄酒中的亚硫酸盐含量[J]. 中国酿造, 2020, 39(3): 162-165. |
| [8] |
陈辰康, 藤根发, 虞雄华. 离子色谱法测定干货制品中的二氧化硫[J]. 化学世界, 2014, 4(1): 25-27. |
| [9] |
张会娟, 谢雅兰, 王朝亚. 测定饮用水中碘化物的含量-离子色谱法和化学法的比较[J]. 城镇供水, 2017(6): 35-38. |
| [10] |
蒋园园, 程海, 徐蕾. 电导和直流安培双检测器离子色谱法测定清洁水样中的碘化物[J]. 环境监控与预警, 2020, 12(2): 31-35. |
| [11] |
郭爱华, 王玮, 袁佗, 等. 离子色谱法同时测定饮用水中11种无机阴离子[J]. 化学分析计量, 2015, 24(4): 32-35. |
| [12] |
高岩. 离子色谱法测定PM2.5中水溶性无机阴离子[J]. 环境与可持续发展, 2015, 40(4): 220-221. |
| [13] |
陈泓霖, 邱国良, 曾琴. 离子色谱法同时测定地下水中5种无机阴离子[J]. 广州化工, 2017, 45(7): 96-99. |
| [14] |
姜燕, 王元有. 淋洗液体系对碱片离子色谱法测定硫酸盐化速率影响研究[J]. 环境监控与预警, 2021, 13(6): 28-30. |
| [15] |
生态环境部. 环境监测分析方法标准制修订技术导则: HJ 168—2020[S]. 北京: 中国环境出版集团, 2020.
|
 2023, Vol. 15
2023, Vol. 15 