2. 江苏科技大学,江苏 镇江 212003
2. Jiangsu University of Science and Technology, Zhenjiang, Jiangsu 212003, China
钴(Co)在人体中是必不可少的过渡金属和微量元素,是维生素B12(钴胺素)和其他生物化合物的常见成分[1-3]。钴(Co)元素可以刺激人骨髓的造血系统,促进血红蛋白的合成和红细胞数量的增加[4]。但是当人体中钴离子(Co2+)浓度过高,可能会造成严重的身体健康问题,如低血压、骨骼缺陷、红细胞增多症、皮肤过敏和活细胞基因突变,对血液和肾脏也会产生不利影响,并会引起呼吸系统和中枢神经系统疾病[5-6]。《生活饮用水卫生标准》(GB 5749—2022) 规定饮用水中Co2+的质量分数不得超过1.0 ×10-6[7-8]。环境中过量的Co2+会抑制微生物的代谢和生长,土壤中过量的Co2+会通过农作物吸收和食物链途径被人体吸收[9]。因此,开发一种高效的土壤中Co2+检测方法具有重要意义。
荧光探针具有灵敏度高、选择性好、响应迅速、操作简便和实时性检测等优点,在检测金属离子方面已经得到广泛的应用[10]。迄今为止,已经开发出了基于金属-配体配位或化学反应的荧光探针,并成功应用于各种金属离子的检测,如锌离子(Zn2+)、钯离子(Pd2+)、铝离子(Al3+)和铜离子(Cu2+)等。Li等[11]设计并合成了推拉式嘌呤核苷型荧光探针L1,探针L1在水缓冲液中的检测限低,对Pd2+具有特定的选择性和灵敏度,因此具有潜在的应用前景。探针L1是首个基于“开-关”型嘌呤核苷的Pd2+荧光探针,具有很出色的荧光淬灭特性。Iniya等[12]通过胺与1,2,4-三唑单元连接的2-羟基-1-萘缩合制备了1种高效的荧光探针。该探针在紫外和荧光检测Zn2+时均表现出优异的选择性和灵敏度。从密度泛函理论计算已经获得了探针与Zn2+的络合方式。成像实验表明,该探针对细胞内的Zn2+可以进行有效检测,具有良好的细胞通透性和生物相容性。Li等[13]首次报道了一种用于Cu2+的新型荧光开启双(二氟硼)-1,2-双(1H-吡咯-2-2基)亚甲基Ⅰ肼(BOPHY)探针。BOPHY显示非常弱的荧光,但是加入Cu2+时,该探针可以发出强荧光。该探针对Cu2+的检测灵敏度高且选择性强,可用于稀释的人血清中Cu2+的检测。此外,BOPHY还在海拉细胞Cu2+的成像中得到应用。Guo等[14]首次合成了在C6处含有冠醚基团的嘌呤类似物,从而拓宽了冠醚化学的范围,并为嘌呤类似物在C6处的修饰开辟了一条新的途径。由此产生的冠嘌呤类似物在水环境中对摩尔浓度极低的银离子(Ag+)表现出选择性和高效的信号传导行为。Gao等[15]设计并合成了1种新型的基于推拉式嘌呤核苷荧光探针L1。探针L1在乙腈/水(V/V=92/8)溶液中对汞离子(Hg2+)有很高的灵敏度和选择性,而且检出限低,为7.8×10-8。同时,探针L1与Hg2+的摩尔浓度呈正比,线性范围为0~4×10-6 mol/L,因此探针L1可用于Hg2+的分析。
由于Co3+的氧化性很强,氧化电位很高,是强氧化剂,容易被还原,且pH值在0.5左右就可以沉淀水解;而Co2+不易被空气氧化,稳定性更好。因此,一般荧光探针检测都以Co2+为研究对象。Lee等[16]通过4-(二乙基氨基)水杨醛和二亚乙基三胺的结合,设计合成了1种简单且易于制备的新型比色化学传感器1。在接近纯水溶液中,存在Co2+时,传感器1显示从无色到黄色的颜色变化。为了研究传感器1对Co2+的感测机理,进行了紫外可见光谱、电喷雾电离(ESI)质谱和理论计算。传感器1对Co2+的检出限为0.65 μmol/L。实际上,传感器1用作带有二氧化硅板的可见测试条,可用于定量检测真实水样中的Co2+。因此,传感器1可能是对Co2+进行现场和实时筛选的良好替代方法。Zhang等[17]报道了一种基于水杨酸衍生物的希夫碱L,并将其用作荧光探针以选择性地检测Co2+。传感器1在乙醇溶液中对Co2+显示增强的荧光响应,从而以高选择性将Co2+与其他金属离子区分开。在最优条件下,传感器1对Co2+的检测限为7.82×10-7 mol/L。该探针在检测环境和生理系统中Co2+浓度方面有广阔的应用前景。
现合成了1种基于香豆素和嘌呤衍生物,高效且易于制备的荧光探针CMP,并将其应用于土壤中Co2+的检测,以期实现高效、快速、准确的分析。
1 实验部分 1.1 实验仪器与试剂仪器:UV-3010紫外分光光度计(日本岛津公司);PHS-25C型pH计(杭州奥立龙公司);BSA124S电子天平(德国赛多利斯公司);Spectofluorometer FS5荧光光谱仪(英国爱丁堡公司);S6型硅胶柱(20 cm×1.5 cm,重庆欣维尔公司)。
试剂:实验试剂见表 1。
| 表 1 实验试剂 |
嘌呤骨架是由咪唑环稠合嘧啶环而成的氮杂环化合物,其环中所有原子共轭、共平面,易发生π电子跃迁。嘌呤环中2,6,8,9位可以通过化学反应接入各种取代基团,结构可变性大,适于结构改造且水溶性好,是合成荧光探针最理想的荧光母体之一。
香豆素及其衍生物由于具有出色的光物理特性(高荧光量子产率)、优异的光稳定性和较低的毒性,因此是理想的荧光团。此外,嘌呤及其衍生物具有识别基团,并且它们的N个原子可以用作优异的配位位点。探针CMP就是一种基于香豆素和嘌呤衍生物的简单、高效且易于制备的新型荧光探针。该探针在4-羟基哌嗪乙磺酸(HEPES)缓冲溶液(pH值= 7.4)中对Co2+表现出高灵敏度、高选择性和快速的响应(<1 min),并且该探针与Co2+结合后可以通过肉眼观察到溶液颜色迅速发生变化。
1.3 探针CMP的合成路线化合物1的合成:在100 mL圆底烧瓶中,加入4-(二乙基氨基)水杨醛(1.93 g,10 mmol)和丙二酸二乙酯(3.20 g,20 mmol),将其溶解在50 mL乙醇中,然后加入哌啶(1 mL)。将混合物在80 ℃下搅拌6 h。反应完成后,将溶剂旋干。粗产物经硅胶柱色谱纯化,用乙酸乙酯/石油醚(V/V=1/7)作为洗脱剂,得到化合物1,为浅黄色油状物(2.61 g,收率90%)。
化合物2的合成:在100 mL圆底烧瓶中,将化合物1(1.90 g,6.56 mmol) 溶解在30 mL乙醇中,然后加入水合肼(1.64 g,32.78 mmol),并将混合物在25 ℃下搅拌30 min。冷却至室温,有固体析出,抽滤,用20 mL冰乙醇洗涤3次。获得化合物2,为亮黄色固体粉末(0.50 g,收率27%)。
化合物3的合成:在100 mL圆底烧瓶中,加入5-氨基-4,6-二氯嘧啶(5.00 g,30 mmol)和1-萘胺(8.58 g,60 mmol)并溶于50 mL甲醇中,然后加入5 mL HCl。将混合物在65 ℃下搅拌24 h。冷却后,将溶剂旋干。然后将粗产品溶于1 mol/L的NaOH溶液中,并将混合物用乙酸乙酯萃取3次。有机相用1.2 mol/L的HCl洗涤,然后用饱和NaCl除水,干燥,得到粗产物。粗产物用CH3OH/H2O(V/V=1/5)重结晶,得到化合物3,为浅紫色固体粉末(5.75 g,收率71%)。
化合物4的合成:将化合物3(5.00 g,18.50 mmol),乙酸(5.88 g,98.00 mmol)和十二烷基三甲基氯化铵(0.45 g,10 mmol)溶解在60 mL的三氯氧磷中,然后加入多聚磷酸(25 g,74 mmol)。将反应混合物在80 ℃下搅拌过夜。反应完成后,将溶剂旋干,得到褐色油状物。将冰水混合物加入该混合物中,析出棕色固体,抽滤,干燥,得到粗产物。将粗产物通过硅胶柱纯化,使用CH3OH/CH2Cl2(V/V=1/250)洗脱,得到化合物4,为白色固体(2.53 g,收率50%)。
探针CMP的合成:在100 mL圆底烧瓶中加入化合物2(0.17 mg,0.64 mmol)和化合物4(0.37 mg,1.27 mmol)溶解于30 mL乙醇中,然后加入三乙胺(2 mL)。将混合物在80 ℃下回流搅拌48 h。反应完成后将该溶液冷却至室温,观察到有黄色固体析出,抽滤并用冰乙醇冲洗,得到探针CMP,为棕黄色固体(0.12 mg,收率36%)。
1.4 溶液的制备HEPES缓冲溶液:在100 mL蒸馏水中溶解0.238 g的4-羟乙基哌嗪乙磺酸,配置成浓度为10 mmol/L的HEPES缓冲溶液。
空白储备液:在500 mL烧杯中倒入300 mL的二甲基亚砜、190 mL蒸馏水和10 mL的HEPES缓冲溶液,配置成0.2 mmol/L的空白储备液,并用1.0 mol/L的HCl溶液和1.0 mol/L的NaOH溶液将其pH值调为7.4。
探针CMP储备液:将探针CMP溶解在二甲基亚砜中,配置成1.0 mmol/L的探针储备液。
金属离子储备液:在蒸馏水中溶解各种金属离子的氯盐,如钠离子(Na+),Zn2+,锡离子(Sn2+),三价铁离子(Fe3+),二价铁离子(Fe2+),Pd2+,锰离子(Mn2+),钙离子(Ca2+),钡离子(Ba2+),钾离子(K+),镉离子(Cd2+),镁离子(Mg2+),Co2+,Cu2+,铬离子(Cr3+),Al3+,碳酸铯(CsCO3),硝酸银(AgNO3)和硝酸铅[Pb(NO3)2],配置成3.0 mmol/L的金属离子储备液。
2 结果与讨论 2.1 探针CMP的金属离子选择性在5 mL的离心管中,加入3 mL的空白储备液、30 μL的探针CMP储备液和50 μL的金属离子储备液,得到不同金属离子的探针CMP的测试溶液,静置1 h后进行测试,激发波长=438 nm,发射波长=482 nm。探针CMP(10 μmol/L)中加入50 μmol/L的各种金属离子后荧光光谱响应见图 1。由图 1可见,探针CMP溶液在加入其他金属离子时,如Sn2+,Fe3+,Fe2+,Na+,Mn2+,Al3+,Ca2+,Ba2+,K+,Cd2+,Mg2+,Cs2+,Pb2+,Cr3+和空白样,在482 nm处会发射出很强的荧光,存在Zn2+和Ag+时会检测到一些较弱的荧光淬灭,只有加入Co2+时,探针溶液的荧光会被完全淬灭。由此可见,探针CMP对Co2+具有很高的选择性。
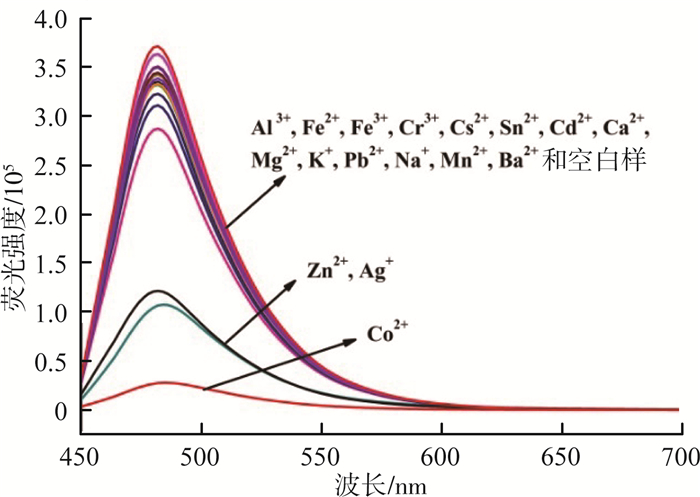
|
图 1 探针CMP的各种金属离子荧光光谱响应 |
响应时间是探针CMP检测Co2+灵敏度的重要参数,因此研究了在0~10 min内,存在Co2+时探针CMP在482 nm处的荧光强度。向3 mL的空白样中加入30 μL的探针CMP储备液和50 μL的Co2+储备液,每分钟测其荧光强度。响应时间对荧光强度的影响见图 2。由图 2可见,向探针CMP溶液中加入Co2+后,荧光强度迅速淬灭至最低,并且在1 min内达到稳定值。由此可见,探针CMP在优化的实验条件下对Co2+能够快速反应。
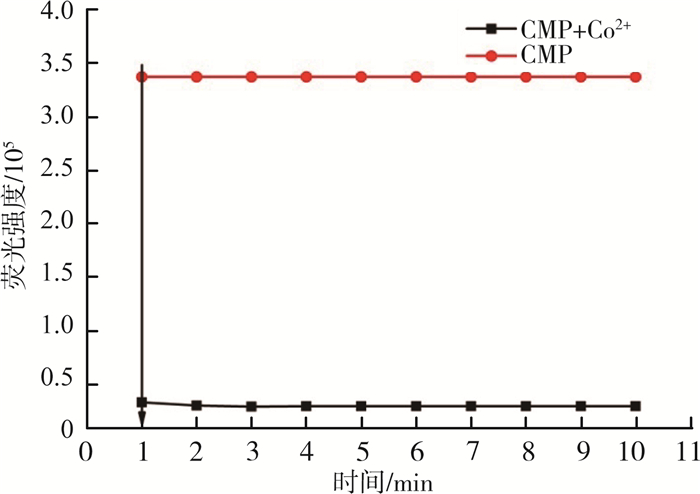
|
图 2 响应时间对荧光强度的影响 |
为了解检测金属离子的最佳条件,研究了pH值为2.0~12.0时,探针CMP与CMP+Co2+的荧光强度。pH值对荧光强度的影响见图 3。由图 3可见,当pH值为7.0~11.0时,在482 nm处探针CMP的荧光强度很高,向其加入Co2+后,探针CMP的荧光强度被大大淬灭。由此可见,探针CMP检测Co2+的最佳pH值为7.0~11.0。因此,本研究中所有的光谱实验均使用pH值= 7.4的HEPES缓冲溶液。
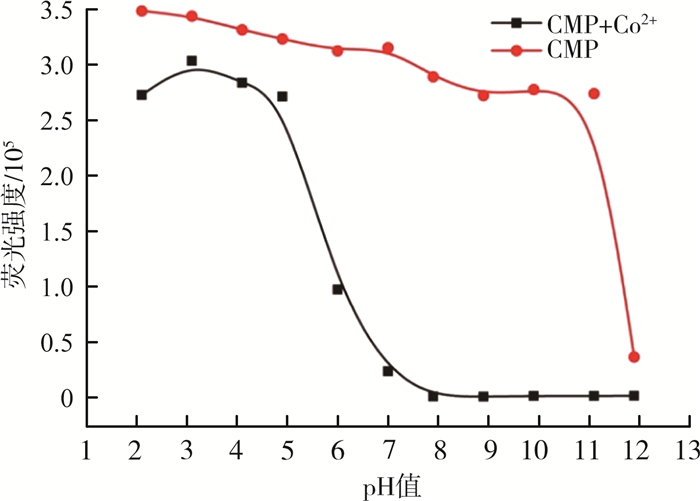
|
图 3 pH值对荧光强度的影响 |
探针CMP的紫外可见吸收和荧光光谱响应见图 4。由图 4可见,探针CMP溶液(10 μmol/L)在434 nm处有紫外吸收峰,而加入Co2+(50 μmol/L) 后,探针CMP溶液的紫外吸收峰红移至473 nm处,同时探针CMP溶液的颜色从黄色变为粉红色。此外,探针CMP在482 nm处表现出很高的荧光强度,但是,加入Co2+后,可以观察到探针CMP的荧光被明显淬灭。由此可见,探针CMP对Co2+具有很高的灵敏度,肉眼可见的颜色变化可能是由于探针CMP和Co2+之间形成了新的配合物。
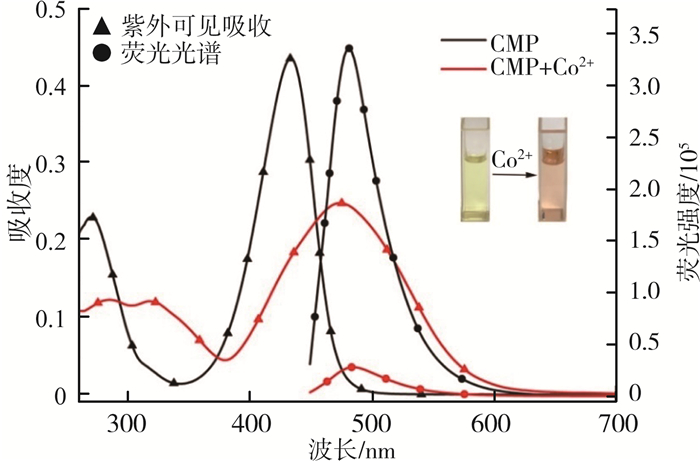
|
图 4 探针CMP的紫外可见吸收和荧光光谱响应 |
为了进一步评估探针CMP对Co2+的灵敏度,在二甲基亚砜/水溶液中进行了探针CMP对Co2+的荧光滴定实验,实验结果见图 5(a)(b)。由图 5可见,随着Co2+浓度的增加,探针CMP在482 nm处的荧光被逐渐淬灭,当Co2+浓度增加到60 μmol/L时,探针CMP在482 nm处的荧光被完全淬灭,同时,探针CMP溶液的荧光从浅蓝色变为无色。
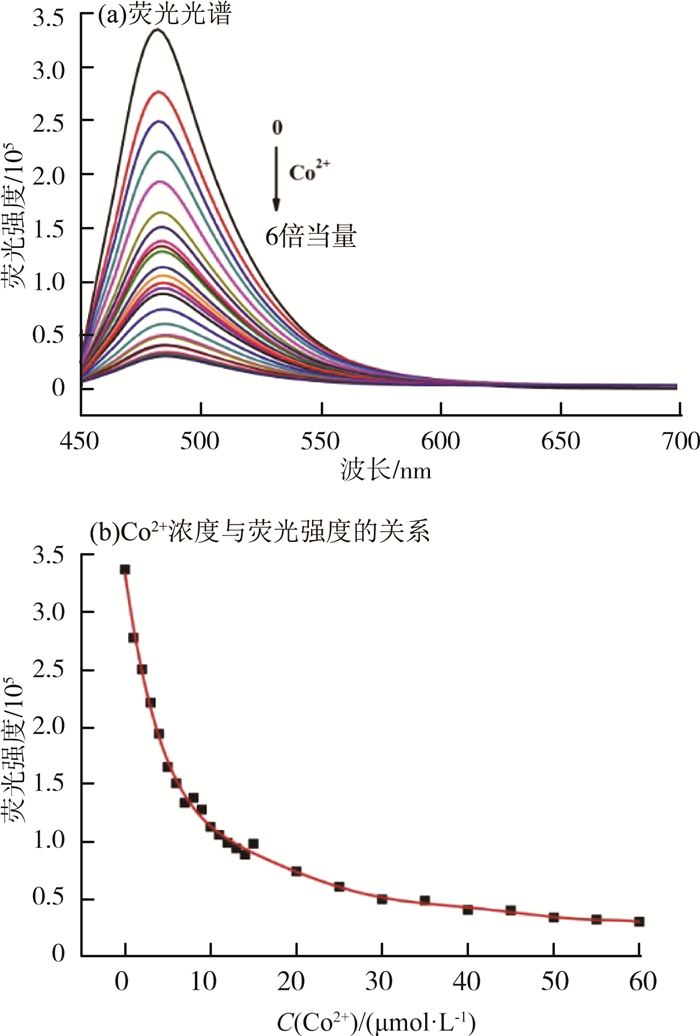
|
图 5 探针CMP对Co2+的荧光滴定实验结果 |
基于探针CMP对Co2+的荧光滴定曲线图,计算探针CMP的检出限。在荧光下降区域取7个点,以Co2+浓度为横坐标,在482 nm处的荧光强度为纵坐标,进行线性拟合,得到直线方程y=24 582.285 72 x+37 805.104 07,决定系数(R2)=0.984 1,结果见图 6。然后再测试10组空白样的荧光强度,记录在482 nm处探针CMP(10 μmol/L) 的荧光强度,计算其标准偏差(SD)。检出限(LOD)根据Stern-Volmer方程计算,LOD=3SD/S,其中S表示直线方程的斜率。经计算,探针CMP的检出限为0.26 mg/kg,说明该探针对Co2+有很高的灵敏度。

|
图 6 荧光强度与Co2+浓度的线性关系 |
对土壤和沉积物标准样品(GSS-27、GSD-20),以及实际样品中Co元素的精密度和准确度进行测定,结果见表 2。
| 表 2 Co元素标准样品、实际样品测定结果 |
由表 2可见,土壤和沉积物标准样品以及实际样品的相对标准偏差(RSD)为1.3%~2.7%,精密度良好。标准样品测定结果均在标准值范围内,准确度良好。说明该方法适用于土壤中Co2+的检测。
3 结语本研究合成了1种基于香豆素和嘌呤衍生物的新型开关荧光探针CMP,并将该方法应用于土壤检测中,通过研究探针CMP对Co2+的响应时间,表明该探针可以快速检测Co2+;通过研究pH值对探针CMP检测Co2+的影响,说明探针CMP检测Co2+的最佳pH值为7.0~11.0。通过荧光滴定实验,计算出探针CMP的检出限为0.26 mg/kg,说明探针CMP对Co2+有很高的灵敏度。同时对实际土壤样品进行准确度和精密度测定,结果表明,本研究在应用于检测土壤中Co2+时具有较高的准确度和精密度。相对于传统酸消解分析法,本方法具有高选择性和高灵敏度,可高效、快速、准确地检测土壤中的Co2+,为今后更广泛地运用于空气、水质和食品中的Co2+检测提供了有益的参考。
| [1] |
SANTANDER P J, KAJIWARA Y, WILLIAMS H J, et al. Structural characterization of novel cobalt corrinoids synthesized by enzymes of the vitamin B12 anaerobic pathway[J]. Bioorganic & Medicinal Chemistry, 2006, 14: 724-731. |
| [2] |
AL-HABSI K, JOHNSON E H, KADIM I T, et al. Effects of low concentrations of dietary cobalt on liveweight gains, haematology, serum vitamin B(12) and biochemistry of Omani goats[J]. Veterinary Journal, 2007, 173: 131-137. DOI:10.1016/j.tvjl.2005.10.002 |
| [3] |
FRANK A, MCPARTLIN J, DANIELSSON R. Nova Scotia moose mystery a moose sickness related to cobalt-and vitamin B12 deficiency[J]. Science of the Total Environment, 2004, 318: 89-100. DOI:10.1016/S0048-9697(03)00374-7 |
| [4] |
GHAZALI S, WANG J, FAN J, et al. Selective imaging of Co2+ in live cells with a "turn-on" fluorescent probe[J]. Sensors And Actuators B-chemical, 2017, 239: 1237-1242. DOI:10.1016/j.snb.2016.09.126complexQuery.action?journalTitle=公路交通科技&year=2018&firstpage=146&issue=09 |
| [5] |
FU X, LI H, LV R, et al. Synthesis of Mn2+ doped ZnS quantum dots/ZIF-8 composite and its applications as a fluorescent probe for sensing Co2+ and dichromate[J]. Journal of Solid State Chemistry, 2018, 264: 35-41. DOI:10.1016/j.jssc.2018.04.021 |
| [6] |
GUO C, LI P, PEI M, et al. A new polythiophene derivative-based fluorescent sensor for Co2+, Cu2+, Cd2+ and its complex with Cu2+ for sensing homocysteine and glutathione[J]. Sensors And Actuators B-chemical, 2015, 221: 1223-1228. DOI:10.1016/j.snb.2015.07.105 |
| [7] |
PINTO A, HERNÁNDEZ G, GAVARA R, et al. Supramolecular tripodal Au(i) assemblies in water, interactions with a pyrene fluorescent probe[J]. New Journal of Chemistry, 2019, 43: 8279-8289. DOI:10.1039/C9NJ00469F |
| [8] |
WU Y, WEN X, FAN Z. An AIE active pyrene based fluorescent probe for selective sensing Hg2+ and imaging in live cells[J]. Spectrochim Acta, 2019, 223: 117315. DOI:10.1016/j.saa.2019.117315 |
| [9] |
REIMANN C, KOLLER F, KASHULINA G. Influence of extreme pollution on the inorganic chemical composition of some plants[J]. Environmental Pollution, 2001, 115: 239-252. DOI:10.1016/S0269-7491(01)00106-3 |
| [10] |
RANGASAMY M, PALANINATHAN K. Thiophene and furan appended pyrazoline based fluorescent chemosensors for detection of Al3+ ion[J]. Inorganic Chemistry Communications, 2019, 101: 177-183. DOI:10.1016/j.inoche.2019.01.038 |
| [11] |
LI J P, WANG H X, WANG H X, et al. Push-pull-type purine nucleoside-based fluorescent sensors for the selective detection of Pd2+ in aqueous buffer[J]. European Journal of Organic Chemistry, 2014, 11: 2225-2230. |
| [12] |
INIYA M, JEYANTHI D, KRISHNAENI K, et al. Triazole based ratiometric fluorescent probe for Zn2+ and its application in bioimaging[J]. Spectrochimica Acta Part A, 2014, 120: 40-46. DOI:10.1016/j.saa.2013.09.107 |
| [13] |
LI Y, ZHOU H, YIN S, et al. A BOPHY probe for the fluorescence turn-on detection of Cu2+[J]. Sensors And Actuators B-chemical, 2016, 235: 33-38. DOI:10.1016/j.snb.2016.05.055 |
| [14] |
GUO H M, WU J, NIU H Y, et al. The synthesis of novel fluorescent purine analogues modified by azacrown ether at C6[J]. Bioorganic & Medicinal Chemistry Letters, 2010, 20: 3098-3102. |
| [15] |
GAO S H, XIE M S, WANG H X, et al. Highly selective detection of Hg2+ ion by push-pull-type purine nucleoside-based fluorescent sensor[J]. Tetrahedron, 2014, 70: 4929-4933. DOI:10.1016/j.tet.2014.05.050 |
| [16] |
LEE S Y, LEE J J, BOK K H, et al. Highly selective and sensitive colorimetric chemosensor for detection of Co2+ in a near-perfect aqueous solution[J]. RSC Advances, 2016, 6: 28081-28088. DOI:10.1039/C6RA03364D |
| [17] |
ZHANG J, LIU Y, FEI Q, et al. A salicylal-derived Schiff base as Co(Ⅱ) selective fluorescent probe[J]. Sensors And Actuators B-chemical, 2017, 239: 203-210. DOI:10.1016/j.snb.2016.07.178 |
 2023, Vol. 15
2023, Vol. 15 