2. 江苏省镇江环境监测中心,江苏 镇江 212009;
3. 江苏大学,材料科学与工程学院,江苏 镇江 212013
2. Zhenjiang Environmental Monitoring Center, Zhenjiang, Jiangsu 212009, China;
3. School of Materials Science and Engineering, Jiangsu University, Zhenjiang, Jiangsu 212013, China
随着工业发展,铅作为一种重要的化工原料,得到了广泛应用。但由于采矿、自然来源以及冶炼企业的不当处理,导致大量铅暴露于环境中,造成了严重的铅污染[1]。由于其不可生物降解性和高毒性,铅离子通过饮用水和食物进入人体后,会在体内积蓄,导致器官受损,特别是中枢神经系统和肾脏,严重时会导致贫血、昏迷或死亡。因此,对环境中痕量铅离子的高灵敏检测十分重要[2-3]。
目前,已通过石墨炉原子吸收光谱法、火焰原子吸收光谱法和电感耦合等离子体质谱法等,建立了用于二价铅离子(Pb2+)的定量分析方法。这些方法虽然具有灵敏度高、测量准确等优点,但也存在一些缺点。石墨炉原子吸收光谱法存在背景吸收干扰严重的问题,若样品未进行前处理而直接进样,对基体产生的干扰更为严重,对分析的准确性也会产生很大的影响。火焰原子吸收光谱法难以直接测定浓度较低的铅样品,需要先对样品进行预富集再检测。电感耦合等离子体质谱法需要采用大型仪器,成本高昂[4-7]。因此,迫切需要开发一种高效、快速和成本低廉的Pb2+检测方法。
近年来,电化学检测技术因其快速、便捷、灵敏度高等优点,越来越受到关注,但存在对目标物的选择性不佳等问题。为了进一步提升电化学检测技术中的传感器对目标物的识别性能,引入了对目标离子具有特异识别性能的离子印迹技术。该技术利用单体和模板离子通过静电作用和配位作用形成聚合物,从聚合物中洗脱离子后,留下了形状和大小与模板相似的结构,可在混合溶液中特异性地识别模板。许多研究将离子印迹技术与电化学技术相结合,结果表明,离子印迹聚合物能有效提高电化学传感器的灵敏度与专一性[8]。因此,将离子印迹技术与电化学分析法结合,制备离子印迹电化学传感器,不仅增强了传感器对目标物质的特异识别性,而且还具有成本低、前处理简单等优点[9-12]。Shamsipur等[13]将铅离子印迹聚合物作为电化学传感器的纳米探针,在1.0×10-12~1.0×10-10 mol/L范围内呈良好的线性关系,检出限为0.3×10-15 mol/L,为HIV-1基因检测提供了一种简单且灵敏度高的方法。Wu等[14]制备了一种基于壳聚糖-石墨烯纳米复合材料的离子印迹电化学传感器,用于测定铬离子,该传感器线性范围为1.0×10-9~1.0×10-5 mol/L,检出限为6.4×10-10 mol/L,具有良好的稳定性和重复性,已将其成功应用于自来水、河水中铬离子的检测。
现结合电化学分析和离子印迹技术,构建了一种高灵敏度的电化学传感器用于Pb2+的检测。通过使用Pb2+作为模板,在介孔硅表面制备了离子印迹聚合物,并将其作为电化学传感器的核心识别元件。通过优化碳糊电极的组成,制备出一系列高选择性的离子印迹电化学传感器,并对其电化学行为进行了详细分析。在实际样本检测中,该传感器展示了高灵敏性和高准确性,在环境监测中具有较好的应用潜力。
1 实验部分 1.1 仪器与试剂仪器:Nicolet Nexus 470傅里叶变换红外光谱仪(美国尼高力公司); CHI 760电化学工作站(上海晨华仪器有限公司),使用三电极体系(3 mm碳糊电极为工作电极,饱和甘汞电极为参比电极,铂丝电极为辅助电极); TriStarⅡ 3020全自动比表面和孔隙分析仪(美国麦克仪器有限公司); MSP-6600微波消解仪(北京瑞利分析仪器有限公司); JSM-7001F扫描电镜(日本电子株式会社); 纤维素滤膜(孔径0.22 μm,盐城普瑞奇实验仪器有限公司)。
试剂:正硅酸四乙酯(TEOS)、3-(γ-氨基乙氨基)-丙基-三甲基硅烷(AAPTS)、十六烷基三甲基溴化铵(CTAB)、无水醋酸锌(≥ 99%),均购于阿拉丁试剂(上海)有限公司; 石蜡油、石墨粉、硝酸铅[Pb(NO3)2]、乙酸、冰醋酸、无水乙酸钠、氯化钾、二水甲酸钠、甲酸、硝酸铜[Cu(NO3)2]、硝酸钴六水合物[Co(NO3)2·6H2O]、硝酸镉四水合物[Cd(NO3)2·4H2O]、硝酸亚铁九水合物[Fe(NO3)2·9H2O]、硝酸锰四水合物[Mn(NO3)2·4H2O](≥97.5%)、氢氧化钠、氯化钠、乙醇、盐酸、硝酸、过氧化氢均购于国药集团化学试剂有限公司。所用试剂除特殊说明外,均为分析纯。铅标准储备液(1 000 μg/mL,北京有色金属研究总院)。大米和面粉样品购于当地超市,水样来自当地河水和自来水。
1.2 铅离子印迹聚合物的制备将0.17 g Pb(NO3)2和0.44 mL的AAPTS加入15 mL蒸馏水,倒入三口烧瓶中,在35 ℃下搅拌2 h。同时,将1 g CTAB溶于25 mL蒸馏水,在40 ℃下搅拌1 h,加入上述溶液中。然后,用2 mol/L的氢氧化钠溶液调节混合溶液的pH值至11.0,并持续搅拌1 h。在剧烈的搅拌下,逐滴加入0.01 mol的TEOS,继续搅拌2 h。将搅拌好的溶液移至高压反应釜中,在150 ℃下反应72 h,产物为未洗脱的铅离子印迹聚合物[未洗脱Pb(Ⅱ)-IIPs]。最后,将生成的固体用布氏漏斗收集,用乙醇和盐酸(1 mol/L)溶液通过索氏提取洗脱聚合物中的Pb2+和模板剂。在60 ℃真空条件下,将印迹聚合物进行干燥,得到洗脱后的铅离子印迹聚合物[Pb(Ⅱ)-IIPs]。
非印迹聚合物的制备,除了不添加模板离子(Pb2+)外,其他操作步骤相同,产物为非印迹聚合物(NIPs)。
1.3 铅离子印迹电极的制备将[Pb(Ⅱ)-ⅡPs]/石墨粉/石蜡油以20 ∶ 60 ∶ 20 (质量比)的比例混合均匀,研磨形成均匀的碳糊。最后,将碳糊填充入直径为3 mm的电极内。随后用称量纸压实,反复打磨,得到所需碳糊工作电极。
1.4 电化学检测方法采用三电极体系,在pH值为5.0,Pb2+浓度为5.0×10-7 mol/L的乙酸-乙酸钠缓冲溶液中吸附240 s。随后,将10 mL浓度为0.12 mol/L的盐酸倒入溶液中,加-1.2 V电压40 s,还原络合物中的Pb2+。最后,在-1.2~0 V范围内,采用差分脉冲伏安法(DPV)进行扫描。
1.5 实际样品分析 1.5.1 自来水和河水自来水和河水通过纤维素滤膜过滤,调节pH值至5.0。用聚乙烯瓶装样,装样瓶预先依次用洗涤剂、去离子水、稀硝酸、去离子水洗涤。
1.5.2 大米和面粉加标方法:(1)将铅标准储备液用0.5 mol/L硝酸稀释为10 ng/mL的铅标准使用液。(2)取10 mL的大米(或面粉)消化液与1 mL的铅标准使用液搅拌混合,用乙酸-乙酸钠缓冲溶液稀释至50 mL,并将溶液的pH值调节至5.0。(3)再取10 mL的大米(或面粉)消化液,除不加铅标准使用液外,其余操作与上述方法一致,作为对照实验。
消解方法:(1)先将样品用研钵研磨,粉末进行过筛。(2)分别称取0.5 g样品,放入2个微波消解罐中,依次加入10 mL浓硝酸和1 mL浓过氧化氢。在室温下反应2 h,放入微波消解仪中进行消解。(3)消化完成后,将消化液倒入聚四氟乙烯烧杯中,置于电加热板上,保持微沸,进行赶酸。至消化液剩余约2 mL时,加入5 mL去离子水,保持微沸至消化液约为1 mL,停止加热并冷却。(4)将消化液转移至容量瓶中,用乙酸-乙酸钠缓冲溶液(0.1 mol/L,pH值=5.0)定容至50 mL。
2 结果与讨论 2.1 铅离子印迹聚合物的制备原理以Pb2+作为模板,硅烷偶联剂(AAPTS)作为功能单体,应用共缩聚法,基于介孔硅表面制备离子印迹聚合物,制备原理见图 1。

|
图 1 铅离子印迹聚合物的制备原理 |
Pb(Ⅱ)-IIPs、未洗脱Pb(Ⅱ)-IIPs和NIPs扫描电镜图见图 2(a)—(c)。由图 2可见,Pb(Ⅱ)-IIPs相对于NIPs表面粗糙度较大,这可能由于在洗脱过程中,部分未在介孔硅表面接枝的聚合物和结合能力弱的粒子被洗脱。由图 2(c)可见,NIPs表面光滑,并且没有团聚的小颗粒分子,表明在介孔硅表面没有形成特定形状的聚合物吸附Pb2+。

|
图 2 Pb(Ⅱ)-IIPs、未洗脱Pb(Ⅱ)-IIPs和NIPs扫描电镜图 |
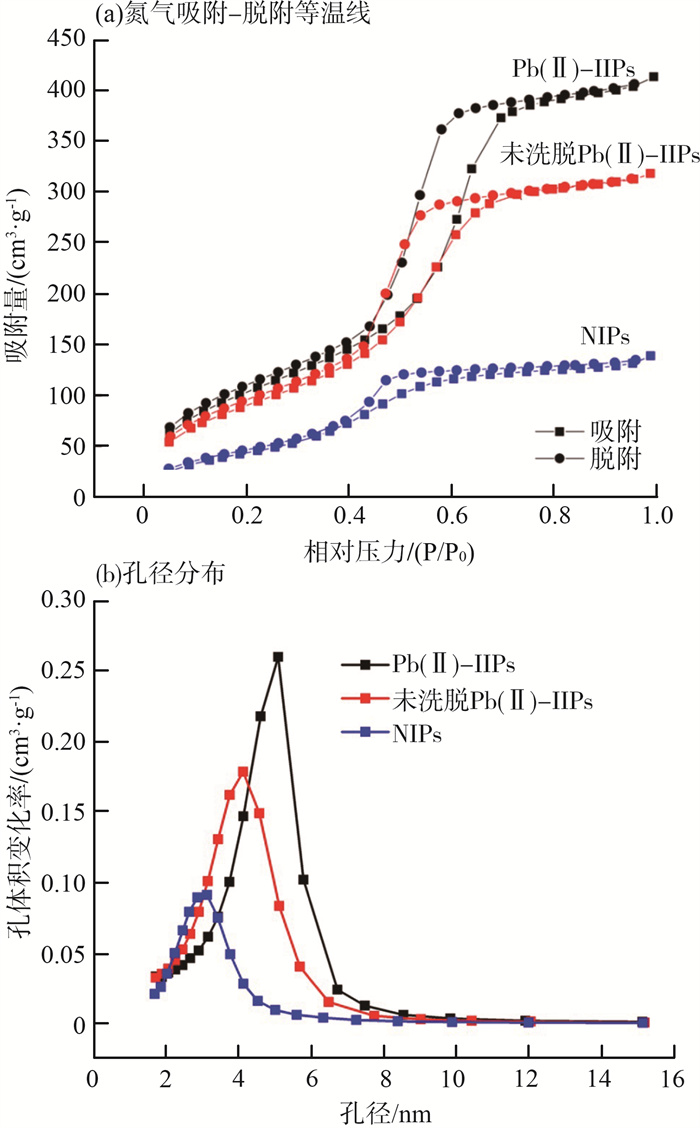
Pb(Ⅱ)-IIPs、未洗脱Pb(Ⅱ)-IIPs和NIPs的氮气吸附-脱附等温线及孔径分布见图 3(a)(b)。
|
图 3 Pb(Ⅱ)-IIPs、未洗脱Pb(Ⅱ)-IIPs和NIPs的氮气吸附-脱附等温线及孔径分布 |
由图 3(a)可见,根据国际纯粹与应用化学联合会(IUPAC)的分类,制备的聚合物呈现出典型的Ⅳ型等温线,并在相对压力(P/P0值)为0.3±0.8之间存在滞后环,说明聚合物生成之后形成了有序的介孔结构。Pb(Ⅱ)-IIPs、未洗脱Pb(Ⅱ)-IIPs和NIPs的比表面积分别为403.49,356.35和179.48 m2/g。由图 3(b)可见,三者孔径大小分别为4.42,3.88和3.16 nm。这是由于Pb(Ⅱ)-IIPs的Pb2+被洗脱,形成印迹空穴,极大地提高了其比表面积与孔径。
2.4 热重分析Pb(Ⅱ)-IIPs、未洗脱Pb(Ⅱ)-IIPs和NIPs的热重分析见图 4。

|
图 4 Pb(Ⅱ)-IIPs、未洗脱Pb(Ⅱ)-IIPs和NIPs的热重分析 |
由图 4可见,在氮气环境下,以10 ℃/ min的升温速率反应,3种样品的热重曲线呈现相同的趋势,表明具有相似的热分解行为(分为A、B、C、D 4个阶段)。(1)A阶段。Pb(Ⅱ)-IIPs:温度为22.0~156.6 ℃,质量损失为6.89%; 未洗脱Pb(Ⅱ)-IIPs:温度为22.0~195.2 ℃,质量损失为4.43%; NIPs:温度为22.0~151.6 ℃,质量损失为6.13%。这是由于聚合物表面物理吸附的水不存在化学键的断裂导致的。(2)B阶段。Pb(Ⅱ)-IIPs:温度为156.6~309.4 ℃,质量损失为17.95%; 未洗脱Pb(Ⅱ)-IIPs:温度为195.2~305.2 ℃,质量损失为13.17%; NIPs:温度为151.6~326.6 ℃,质量损失为30.02%。这是由于聚合物中的表面活性剂的热分解作用导致的。(3)C、D阶段。Pb(Ⅱ)-IIPs:温度为309.4~1 000 ℃,总质量损失为21.95%; 未洗脱Pb(Ⅱ)-IIPs:温度为305.2~ 1 000 ℃,总质量损失为16.38%; NIPs:温度为326.6~1 000 ℃,总质量损失为8.25%。这是由于聚合物中的硅烷偶联剂基团的热分解作用导致的。
2.5 电极条件优化电极条件影响因素分析见图 5(a)—(f)。图 5(a)为0.1 mol/L的盐酸、氯化钾、甲酸-甲酸钠和乙酸-乙酸钠对Pb2+溶液的峰电流值的影响,采用乙酸-乙酸钠时峰电流值最高。因此,选择0.1 mol/L的乙酸-乙酸钠作为缓冲溶液。图 5(b)为选择0.1 mol/L乙酸-乙酸钠溶液和0.1 mol/L磷酸缓冲溶液(PBS)时pH值对Pb2+溶液的峰电流值的影响。随着pH值的增加,峰电流值逐渐增加,在pH值为5.0时达到最大值。这可能是由于酸性越大,溶液中高浓度的氢离子(H+)和Pb2+竞争,减弱了Pb2+和印迹聚合物中氧原子之间的作用力,导致峰电流值减小。pH值继续增大,峰电流值减小。这可能是由于溶液中Pb2+与氢氧根离子(OH-)反应形成氢氧化物沉淀,导致溶液中的Pb2+浓度降低,吸附减少。因此,选择缓冲溶液pH值=5.0。

|
图 5 电极条件影响因素分析 |
图 5(c)为不同比例的石墨粉、石蜡油和Pb(Ⅱ)-IIPs混合制成的碳糊电极的峰电流响应曲线。其中石蜡油的质量分数均为20%,Pb(Ⅱ)-IIPs质量占混合制成碳糊电极总质量的质量分数分别为5%,10%,15%,20%和25%。随着Pb(Ⅱ)-IIPs质量分数的增加,电极的峰电流值不断增加; 超过20%后,峰电流值明显下降。这可能是由于碳糊电极中的Pb(Ⅱ)-IIPs本身的导电性能较差,质量分数增多后,电极的导电性变弱,峰电流值变小。最佳条件制备碳糊电极的石墨粉、Pb(Ⅱ)-IIPs和石蜡油的质量比是60 ∶ 20 ∶ 20。
使用溶出伏安法进行分析检测时,富集是关键步骤。图 5(d)为吸附电压对Pb2+溶液的峰电流值的影响。当电压从-0.4 V增加到-1.2 V时,峰电流值达到最大值,继续增加到-1.4 V后,峰电流值有轻微的减小。因此,选择吸附电压为-1.2 V。
图 5(e)为富集时间对Pb2+溶液的峰电流值的影响,随着时间从30 s增加到240 s,峰电流值逐渐增加,当时间为240 s时,继续增加富集时间,峰电流值几乎不变,表明电极表面吸附Pb2+的量达到饱和。因此,综合考虑吸附效率和灵敏度,选取240 s作为最佳富集时间。图 5(f)为还原平衡时间对Pb2+溶液的峰电流值的影响。在10~40 s范围内,随着时间的增加,峰电流值也随之增加,可能由于络合物中被还原的Pb2+浓度逐渐增多。当超过40 s后,峰电流值减小,可能是由于电极表面的Pb2+几乎被完全还原。因此,选择还原平衡时间为40 s。
2.6 电极性能对比分析Pb(Ⅱ)-IIPs、未洗脱Pb(Ⅱ)-IIPs和NIPs的差分脉冲伏安响应峰值比较见图 6。由图 6可见,未洗脱Pb(Ⅱ)-IIPs的峰电流最大,这是由于其含有更多的Pb2+,导致溶出的Pb2+浓度比其余两者大,峰电流值高。未洗脱Pb(Ⅱ)-IIPs在-0.85 V处有一个小的响应电流,可能由于其中存在杂质,加上负电压后溶出的Pb2+数量更多,发生更多的氧化还原反应,导致更多的电子迁移,使得峰电流值发生变化。当Pb(Ⅱ)-IIPs在-0.85 V处,响应峰电流消失,说明Pb2+和表面活性剂洗脱完成。NIPs的峰电流值比Pb(Ⅱ)-IIPs的峰电流值要小,可能由于NIPs与Pb2+的匹配度差,导致峰电流值低。

|
图 6 Pb(Ⅱ)-IIPs、未洗脱Pb(Ⅱ)-IIPs和NIPs的差分脉冲伏安响应峰值比较 |
在痕量金属离子的测定中,离子间的干扰是一个需要仔细处理的问题。当测定溶液中的Pb2+浓度为5.0×10-7 mol/L时,实验数据表明,即使在高达100倍浓度的情况下,镉离子(Cd2+)和钴离子(Co2+)对Pb2+的测定没有影响。
这可能是因为Cd2+和Co2+在电化学测定中的行为与Pb2+不同,它们在电极上的还原或沉积电位与Pb2+相差较大,因此不会在Pb2+的测定电位范围内产生干扰信号。三价铁离子(Fe3+)在高达50倍浓度时也不会干扰Pb2+的测定。这可能是由于Fe3+在测定的pH值条件下形成了难溶的氢氧化铁沉淀,或者其还原电位与Pb2+的还原电位不重叠,从而避免了电信号的干扰。
然而,铜离子(Cu2+)在10倍以上浓度时会对Pb2+的测定产生干扰。这种干扰可能是由于Cu2+与Pb2+在电极上有相似的电化学行为,导致它们的信号在电位上重叠,或者Cu2+在电极表面的吸附或反应更为优先,从而影响了Pb2+的信号。为了消除Cu2+的干扰,加入了氰基(CN-)作为络合剂。CN-与Cu2+形成了强稳定的络合物[Cu(CN)4]2-,这显著降低了Cu2+的自由离子浓度。由于络合物的形成,Cu2+在电极表面的活性减弱,不再与Pb2+竞争电极表面的还原或沉积位置。因此,即使在Cu2+浓度高达50倍的情况下,Pb2+的测定也不受影响,峰电流值反映的主要是Pb2+的浓度。
2.8 电化学传感器的重现性分析电极测定样品后,电极表面用粗糙滤纸打磨,即可进行下一次测定。用同一电极对5.0×10-7 mol/L的Pb2+溶液进行5次重复测定,峰电流值的相对标准偏差(RSD)为6.4%。用5个电极对5.0×10-7 mol/L的Pb2+溶液进行5次测定,峰电流值的RSD为2.7%。由实验结果可知,介孔硅/离子印迹聚合物修饰的电极作为传感器元件,其重现性较好。
2.9 电化学传感器的分析性能采用溶出伏安法,先对不同浓度的Pb2+溶液进行吸附,将其还原成铅原子,在-0.8 V电压下将铅原子溶出,测定响应电流。铅离子印迹电化学传感器在最优条件下的标准曲线见图 7。由图 7可见,该传感器的检测Pb2+浓度的线性范围为10-9~10-6 mol/L,检出限为1.3×10-11 mol/L(信噪比=3)。Han等[15]利用荧光金属纳米簇修饰的Cu2+建立了Pb2+的荧光检测方法,在2.0×10-4~7.0×10-4 mol/L范围内与Pb2+浓度呈线性关系,检测限为1.1×10-4 mol/L。Wang等 [16]用表面增强拉曼散射法(SERS)对铅离子进行检测,在2.0×10-8~1.0×10-6 mol/L范围内呈良好的线性关系,检出限为2.0×10-8 mol/L。Zhang等 [17]建立了一种基于双发射锰掺杂硫化锌量子点的新型比率荧光探针,探针对Pb2+浓度的荧光强度比在1.0×10-8~6.0×10-8 mol/L显示出良好的线性关系,检出限为5.0×10-10 mol/L。通过与其他检测方案的比较,本实验设计的铅离子印迹电化学传感器显示了非常好的分析特性,具有更宽的线性范围和更低的检出限。

|
图 7 铅离子印迹电化学传感器在最优条件下的标准曲线 |
为了检测当溶液中存在干扰离子的情况下,介孔硅离子印迹聚合物碳糊电极的选择性能,确保进行差分脉冲伏安法检测时,其他离子对于检测Pb2+的干扰可控。因此对含有其他浓度的金属离子的Pb2+溶液(5×10-7mol/L)进行检测。Cd2+、Co2+、Cu2+和Fe3+对Pb2+在不同浓度比值下的影响见图 8(a)—(d)。由图 8可见,当Cd2+和Co2+的浓度为Pb2+的1,25,50和100倍时,它们对Pb2+信号的干扰不显著。当Fe3+的浓度为Pb2+的1,25和50倍时,对Pb2+的测定同样未表现出明显的干扰。然而,随着Cu2+浓度增加至10,25和50倍,其可能对Pb2+的检测产生影响。为了克服这种干扰,实验中引入了CN-作为缓冲液的一部分,以形成稳定的Cu2+络合物,从而减少了Cu2+对Pb2+测定的影响。通过这种方法,即使在Cu2+浓度高于Pb2+浓度50倍的情况下,Pb2+的检测也未受到显著干扰。

|
图 8 Cd2+、Co2+、Fe3+和Cu2+对Pb2+在不同浓度比值下的影响 |
选择自来水、河水、面粉和大米作为研究对象,检测样品中的Pb2+浓度,实验结果见表 1。由表 1可见,相对标准偏差(RSD)较低,为2.5%~7.4%。回收率为98.8%~102.9%。实验结果表明,制备的电化学传感器可有效用于实际样品中Pb2+的检测,方法具有较高的重现性和可靠性。这项研究为开发更有效的方法和工具,监测有害金属离子在环境和食品中的存在提供了有益的启示。
| 表 1 实际样品的检测结果(n=3) |
结合离子印迹技术和电化学分析法,成功制备了一种基于介孔硅的Pb(II)-IIPs,并被进一步应用于构建电化学传感器,通过优化碳糊电极的组分比例,实现了对Pb2+的高灵敏度和高选择性检测。该电化学传感器对Pb2+的检测在10-9~10-6 mol/L范围内线性良好,最低检出限为1.3×10-11 mol/L。在实际样品分析中,该传感器对河水、自来水、面粉和大米样品中的Pb2+进行了有效检测,RSD为2.5%~7.4%,回收率为98.8%~102.9%,证明了其在实际样品检测中的精密度和准确度。本研究开发的基于Pb(II)-IIPs的电化学传感器为重金属Pb2+的环境监测和食品安全分析提供了一种高效、可靠的检测手段。
| [1] |
MARTINS B L, CRUZ C C V, LUNA A S, et al. Sorption and desorption of Pb2+ ions by dead Sargassum sp. biomass[J]. Biochemical Engineering Journal, 2006, 27(3): 310-314. DOI:10.1016/j.bej.2005.08.007 |
| [2] |
JAN A T, AZAM M, SIDDIQUI K, et al. Heavy metals and human health: Mechanistic insight into toxicity and counter defense system of antioxidants[J]. International Journal of Molecular Sciences, 2015, 16(12): 29592-29630. DOI:10.3390/ijms161226183 |
| [3] |
BARANOWSKA-BOSIACKA I, DZIEDZIEJKO V, SAFRANOW K, et al. Inhibition of erythrocyte phosphoribosyltransferases (APRT and HPRT) by Pb2+: A potential mechanism of lead toxicity[J]. Toxicology, 2009, 259(1-2): 77-83. DOI:10.1016/j.tox.2009.02.005 |
| [4] |
PAN J, WANG S, ZHANG R. A novel Pb(Ⅱ)-imprinted IPN for selective preconcentration of lead from water and sediments[J]. International Journal of Environmental Analytical Chemistry, 2006, 86(11): 855-865. DOI:10.1080/03067310600665654 |
| [5] |
LIU Y, LIU Z, GAO J, et al. Selective adsorption behavior of Pb(Ⅱ) by mesoporous silica SBA-15-supported Pb(Ⅱ)-imprinted polymer based on surface molecularly imprinting technique[J]. Journal of Hazardous Materials, 2011, 186(1): 197-205. DOI:10.1016/j.jhazmat.2010.10.105 |
| [6] |
陈晓, 谭学才, 严军, 等. 3D石墨烯修饰的猛杀威分子印迹电化学传感器的制备[J]. 分析化学, 2016, 44(12): 1834-1839. |
| [7] |
DAHAGHIN Z, MOUSAVI H Z, SAJJADI S M. A novel magnetic ion imprinted polymer as a selective magnetic solid phase for separation of trace lead(Ⅱ) ions from agricultural products, and optimization using a Box-Behnken design[J]. Food Chemistry, 2017, 237: 275-281. DOI:10.1016/j.foodchem.2017.05.118 |
| [8] |
KAZEMI E, DADFARNIA S, HAJI SHABANI A M, et al. Synthesis, characterization, and application of a Zn (Ⅱ)-imprinted polymer grafted on graphene oxide/magnetic chitosan nanocomposite for selective extraction of zinc ions from different food samples[J]. Food Chemistry, 2017, 237: 921-928. DOI:10.1016/j.foodchem.2017.06.053 |
| [9] |
PRASAD B B, SINGH R, SINGH K. Development of highly electrocatalytic and electroconducting imprinted film using Ni nanomer for ultra-trace detection of thiamine[J]. Sensors and Actuators B: Chemical, 2017, 246: 38-45. DOI:10.1016/j.snb.2017.02.033 |
| [10] |
LIU S, TIAN J, WANG L, et al. Hydrothermal treatment of grass: a low-cost, green route to nitrogen-doped, carbon-rich, photoluminescent polymer nanodots as an effective fluorescent sensing platform for label-free detection of Cu(Ⅱ) ions[J]. Advanced Materials, 2012, 24(15): 2037-2041. DOI:10.1002/adma.201200164 |
| [11] |
MAHER S, BASIT H, FORSTER R J. Micron dimensioned cavity array supported lipid bilayers for the electrochemical investigation of ionophore activity[J]. Bioelectrochemistry, 2016, 112: 16-23. DOI:10.1016/j.bioelechem.2016.07.002 |
| [12] |
RAO H, CHEN M, GE H, et al. A novel electrochemical sensor based on Au@PANI composites film modified glassy carbon electrode binding molecular imprinting technique for the determination of melamine[J]. Biosensors and Bioelectronics, 2017, 87: 1029-1035. DOI:10.1016/j.bios.2016.09.074 |
| [13] |
SHAMSIPUR M, SAMANDARI L, FARZIN L, et al. Development of an ultrasensitive electrochemical genosensor for detection of HIV-1 pol gene using a gold nanoparticles coated carbon paste electrode impregnated with lead ion-imprinted polymer nanomaterials as a novel electrochemical probe[J]. Microchemical Journal, 2021, 160: 105714. DOI:10.1016/j.microc.2020.105714 |
| [14] |
WU S, DAI X, CHENG T, et al. Highly sensitive and selective ion-imprinted polymers based on one-step electrodeposition of chitosan-graphene nanocomposites for the determination of Cr(VI)[J]. Carbohydrate Polymers, 2018, 195: 199-206. DOI:10.1016/j.carbpol.2018.04.077 |
| [15] |
HAN B, HOU X, XIANG R, et al. Detection of lead ion based on aggregation-induced emission of copper nanoclusters[J]. Chinese Journal of Analytical Chemistry, 2017, 45(1): 23-27. DOI:10.1016/S1872-2040(16)60985-4 |
| [16] |
WANG Y, IRUDAYARAJ J. A SERS DNAzyme biosensor for lead ion detection[J]. Chemical Communications, 2011, 47(15): 4394. DOI:10.1039/c0cc04140h |
| [17] |
ZHANG F, LIU Y, MA P, et al. A Mn-doped ZnS quantum dots-based ratiometric fluorescence probe for lead ion detection and "off-on" strategy for methyl parathion detection[J]. Talanta, 2019, 204: 13-19. DOI:10.1016/j.talanta.2019.05.071 |
 2024, Vol. 16
2024, Vol. 16 

