头孢菌素是7-氨基头孢烷酸的衍生物,结构上属于β-内酰胺类抗生素[1]。自合成以来,被广泛应用于人畜疾病防治上,是目前临床用量最多的一类抗生素[2]。部分头孢菌素通过生物体的药用作用后被排出体外[3],还有大量药物或原料药因过期变质或未使用被直接处理,最终成为生活、医疗或养殖污水[4]。据报道,在城市污水、地表水,甚至自来水中均有异常高值的头孢菌素被检出[5-6]。
水质中头孢菌素的分析方法主要是液相色谱-紫外检测法和液相色谱-串联质谱法[7]。其中液相色谱-紫外检测法的成本相对较低,但能同时检测的化合物较少,可用于头孢菌素标样的定值分析。该方法只能通过保留时间定性,存在假阳性检出、准确性较差、灵敏度偏低等问题,不适用于同时分析多种环境基质中的痕量头孢菌素[8]。近10年来,以液相色谱-串联质谱法为代表的高分辨质谱技术被越来越广泛地应用于复杂基质中头孢菌素的分析[9]。该方法以高选择性的质谱作为检测器,基质背景干扰少,定性分析结果可靠,灵敏度较高,是一种集多组分定性、定量和高效分离于一体的分析技术。目前国家标准中关于动物源性食品中的头孢菌素分析,均采用液相色谱-串联质谱法[10-12]。而水质中头孢菌素分析虽暂无相关国家标准,但分析方法可同理参考。
目前,水质中头孢菌素的前处理方法主要采用固相萃取法(SPE)[13-14]。SPE技术是利用固相萃取小柱选择性地吸附水质中的待测组分,使之与基质分离,再用洗脱液洗脱,以达到富集和净化的目的,方法回收率高、净化效果好[15-16]。但传统手动/半自动SPE技术常包含多个步骤,会影响实验人员身体健康。全自动固相萃取法(ASPE)是一种新型的全自动萃取技术,可实现样品上样、富集、洗脱、浓缩和溶剂转换的一体化前处理,方法操作简单,缩短了前处理时间,减少了人为误差,可保证结果的一致性。此外,该方法减少了与有毒有害化学试剂的接触,保障了实验人员的健康和安全[17]。
现针对环境中常检出的18种头孢菌素(头孢羟氨苄、头孢他啶、头孢克肟、头孢吡肟、头孢丙烯、头孢匹罗、头孢氨苄、头孢拉定、头孢克洛、头孢噻肟、头孢洛宁、头孢呋辛、头孢唑林、头孢替安、头孢匹林、头孢哌酮、头孢噻呋、头孢呋辛酯),参考《生活饮用水及水源水中10中抗生素的检验方法超高效液相色谱-质谱/质谱法》(DB22/T 2838—2017)[18],利用全自动固相萃取仪进行一体化的自动前处理,联用超高效液相色谱串联质谱(UPLC-MS/MS)技术,建立了一种准确、高效且适用于地表水中头孢菌素残留的分析检测方法。
1 实验部分 1.1 仪器、试剂与耗材仪器:API4000三重四极杆液质联用仪(上海爱博才思分析仪器贸易有限公司);ASPE 900全自动固相萃取仪(广州盛康仪器有限公司);Oream 2000标准溶液稀释仪(上海兰博贸易有限公司)
试剂:纯水(Mill-Q纯水机制);乙腈、甲醇、丙酮、甲酸(色谱纯,德国默克公司);18种头孢菌素标准品(≥95%,上海安谱实验科技股份有限公司)。
耗材:聚四氟乙烯(PTFE)针式过滤头(孔径0.22 μm,上海安谱实验科技股份有限公司);C18固相萃取小柱、HLB固相萃取小柱(200 mg/6 mL,广州盛康仪器有限公司);BEH Shield RP18色谱柱(1.7 μm,2.1 mm×100 mm)、BEH C8色谱柱(1.7 μm,2.1 mm×100 mm)和BEH C18色谱柱(1.7 μm,2.1 mm×100 mm),均购自上海沃特世科技有限公司。
1.2 头孢菌素标准储备液的配置分别精确称取(5.0±0.1)mg的18种头孢菌素标准品于10 mL棕色容量瓶中,用甲醇/水/丙酮(体积比为1 ∶ 1 ∶ 1)的混合溶剂溶解,定容成500 mg/L的头孢菌素标准储备液,于-20 ℃保存,临用时再用纯水稀释成相应的标准系列溶液。
1.3 试样制备头孢菌素在避光、弱酸性条件和甲醇含量低的情况下,性质较稳定[18-19]。因此,取1 000 mL地表水置于棕色玻璃瓶内作为1个样品,并调节pH值至4~6,再加入2 mL甲醇,确保头孢菌素的稳定性。
使用HLB小柱,对采集的水样进行全自动化固相萃取富集。方法为:先依次用5 mL甲醇和5 mL水活化固相萃取小柱,以10 mL/min的流速加载水样,样品加载结束后,采用抽真空和氮吹的叠加模式干燥小柱,最后用10 mL 1.0%(V/V) 的甲酸溶液(溶剂为甲醇)分2次以2 mL/min的低流速缓慢洗脱,收集的洗脱液于50 ℃下由氮气吹干,用1.0 mL纯水溶解,涡旋震荡后经0.22 μm PTFE滤膜过滤,进UPLC-MS/MS分析。
1.4 实验条件 1.4.1 液相色谱条件色谱柱:BEH Shield RP18、BEH C8、BEH C18,经实验对比,优选色谱柱BEH Shield RP18。
柱温:30 ℃;进样量:10.0 μL;流量:0.3 mL/min;流动相A为水,含0.1%的甲酸,流动相B为乙腈。梯度洗脱程序:0~2.5 min,96%A;2.5~3 min,96%~89%A;3~6 min,89%A;6~10 min,89%~12%A;10~10.5 min,12%~94%A;12~13 min,94%A。
1.4.2 质谱条件电喷雾正离子模式(ESI+):碰撞气为41.37 kPa,气帘气为172.37 kPa,雾化气和辅助加热气均为344.74 kPa,喷雾电压为5 500 V,离子源温度为450 ℃。多反应监测(MRM)模式扫描,质谱参数详见表 1(化合物按照出峰顺序排列)。
| 表 1 18种头孢菌素的MRM质谱参数① |
对50.0 μg/L的标准系列进样分析,对比了UPLC系统的3种色谱柱(BEH C18、BEH C8和BEH Shield RP18) 的分离效果,结果见图 1(a)—(c)(化合物序号同表 1)。由图 1可见,采用BEH C8柱,组分色谱峰较宽,分离度较差。对比BEH C18柱和BEH Shield RP18柱对极性较大的头孢羟氨苄、头孢他啶、头孢克肟和头孢吡肟(化合物1—4)的分离效果明显更佳,同时对头孢匹罗、头孢氨苄、头孢拉定等(化合物6—13)中等极性的化合物的分离效果更好。
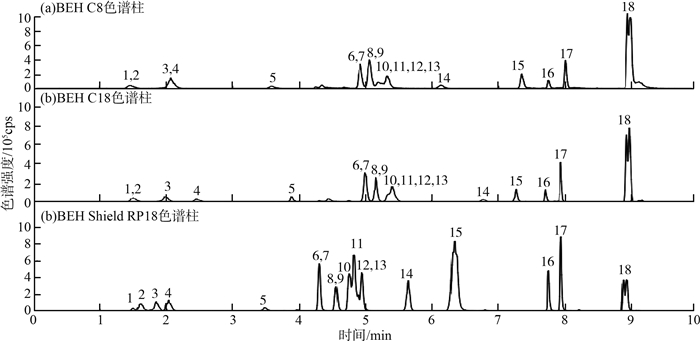
|
图 1 3种色谱柱总离子流色谱图对比 |
采用全自动固相萃取仪对水中18种头孢菌素进行前处理,考察了C18和HLB 2种固相萃取小柱,在1 000 mL纯水空白样品中进行头孢菌素的加标实验,加标量为50 ng,比较了二者的回收率,结果见图 2。由图 2可见,C18柱的回收率整体明显偏低,仅有8.0%~35.2%,而HLB柱的回收率除头孢羟氨苄(65.5%)以外,其他均为75.1%~92.8%,整体均明显高于C18柱。头孢羟氨苄的回收率偏低,可能与结构中的羟基有关,羟基易与水分子形成氢键,导致在HLB吸附时造成损失。
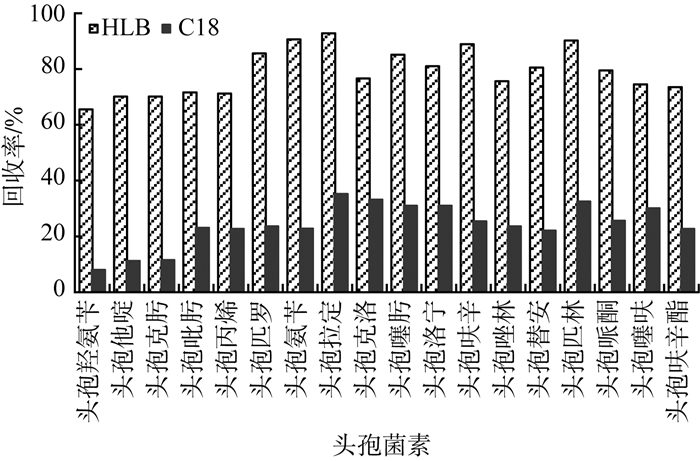
|
图 2 2种固相萃取小柱回收率对比 |
采用全自动固相萃取法做前处理,除固相萃取小柱外,洗脱剂也是影响前处理效率的重要因素之一。经文献调研,采用酸化甲醇做洗脱试剂,比用纯甲醇洗脱回收率有明显改善[18-19]。因此对加标量为50 ng的纯水空白样品进行加标实验,以酸化甲醇为洗脱试剂,HLB为固相萃取小柱,进行全自动固相萃取,对洗脱剂中甲酸的体积分数进行优化。实验分别考察了甲酸体积分数为0.1%,0.5%,1.0%,2.0%和5.0%酸化甲醇的回收率,结果见图 3。由图 3可见,甲酸体积分数为0.1%~2.0%时,随着甲酸体积分数的增加,回收率明显增加,但甲酸体积分数增加至2.0%后,对极性较大的头孢羟氨苄和头孢拉定的回收率有一定抑制,所以选择甲酸体积分数为1.0%的酸化甲醇溶液作为洗脱剂。
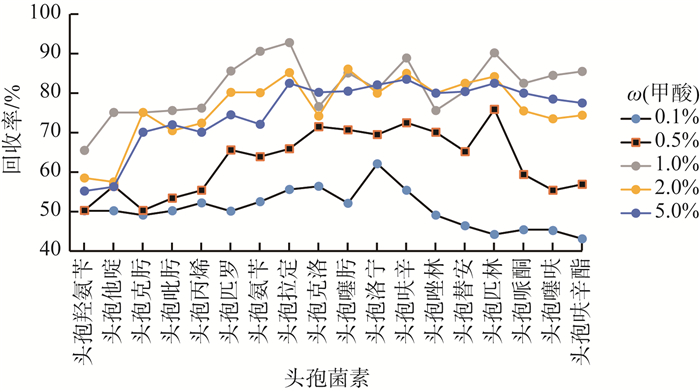
|
图 3 甲酸的体积分数对目标化合物回收率的影响 |
将1.2节中配制的18种头孢菌素标准储备液(500 mg/L),用纯水稀释成5.0,10.0,20.0,50.0,100 μg/L 5个质量浓度的标准系列。按照1.4节的分析方法进行检测,以各头孢菌素质量浓度(x) 为横坐标、峰面积(y) 为纵坐标,绘制标准曲线。对加标量为5.0 ng的纯水空白样品,按照样品分析的全步骤重复n次实验,参照《环境监测分析方法标准制订技术导则》(HJ 168—2020)[20]附录A中的公式计算方法检出限(MDL),以4倍MDL为测定下限。MDL计算公式见式(1)。
| $ \mathrm{MDL}=t_{(n-1, 0.99)} \times S $ | (1) |
式中:n——样品的平行测定次数;t——自由度为n-1,置信度为99%时的t分布值;S——n次平行测定的标准偏差。
18种头孢菌素的标准曲线、相关系数、方法检出限和测定下限见表 2。由表 2可见,18种头孢菌素在5.0~100 μg/L质量浓度范围内线性关系良好,相关系数(r)均>0.999,方法检出限为0.5~1.8 ng/L,测定下限为2.0~7.2 ng/L。
| 表 2 18种头孢菌素的标准曲线、相关系数、方法检出限和测定下限(n=7) |
对地表水样品进行低、中、高3个质量浓度水平的加标实验,以此考察方法的精密度和准确度,分别以相对标准偏差(RSD)和回收率表征,加标量分别为5.0,20.0和100 ng,每个加标水样进行6次重复实验。18种头孢菌素的精密度和准确度见表 3。由表 3可见,RSD为0.5%~14.5%,3个加标量的加标回收率分别为64.3%~92.0%,65.5%~92.8%和65.3%~89.3%,无明显差异,可见前处理方法能够有效提取出目标化合物,且能够保持结果的稳定性及准确性。
| 表 3 18种头孢菌素的精密度和准确度(n=6) |
建立了地表水中18种典型头孢菌素的全自动固相萃取-超高效液相色谱串联质谱的分析方法,并进行相关实验条件的优化。在最优条件下测得18种头孢菌素在5.0~100 μg/L范围内具有良好的线性关系,加标回收率为64.3%~92.8%,RSD<15%,方法的精密度和准确度均可满足地表水中痕量头孢菌素残留的检测要求。该方法自动化程度高,结果稳定可靠,适用于地表水中头孢菌素的分析。
| [1] |
程恒友. 上海市污水处理厂中头孢类抗生素的迁移转化规律[D]. 上海: 上海应用技术大学, 2020.
|
| [2] |
潘葳, 罗钦, 刘文静. 水产品与水产饲料中药物残留问题的分析及对策[J]. 福建农业学报, 2011, 26(6): 1096-1100. |
| [3] |
杨宇轩, 冯启言, 王秋旭. 我国地表水体中抗生素污染的研究进展[J]. 环境与健康杂志, 2019, 36(3): 261-264. |
| [4] |
GULKOWSKA A, LEUNG H W, SO M K, et al. Removal of antibiotics from wastewater by sewage treatment facilities in Hong Kong and Shenzhen, China[J]. Water Research, 2008, 42(1): 395-398. |
| [5] |
LI J S, QIU Y M, WANG C. Veterinary drug residue analysis[J]. Science and Technology Press, 2002, 301-305. |
| [6] |
刘昔, 王智, 王学雷. 我国典型区域地表水环境中抗生素污染现状及其生态风险评价[J]. 环境科学, 2019, 40(5): 2094-2099. |
| [7] |
王敏. 水中多种抗生素残留同时检测新技术的研究[D]. 山东: 烟台大学, 2017.
|
| [8] |
冯丽雄, 彭莺, 吴伟东, 等. SPE-UPLC测定制药企业污水中7种头孢抗生素[J]. 山东化工, 2020, 50(20): 100-102. |
| [9] |
程建桥, 张峰, 许秀丽, 等. 超高效液相色谱-高分辨质谱法筛查婴幼儿配方奶粉中17种头孢菌素类药物残留[J]. 色谱, 2018, 36(8): 809-816. |
| [10] |
DONG L, MENG L, LIU H, et al. Effect of cephalosporin treatment on the microbiota and antibiotic resistance genes in feces of dairy cows with clinical mastitis[J]. Antibiotics, 2022, 11(1): 21-25. |
| [11] |
莫楠, 张立佳, 吕志勇, 等. PRIME HLB固相萃取/超高效液相色谱-串联质谱法测定乳制品中头孢菌素类药物残留[J]. 乳业科学与技术, 2018, 41(4): 29-32. |
| [12] |
章豪, 吴银良, 张宜文, 等. PRIME HLB固相萃取-超高效液相色谱-串联质谱法测定蜂产品中10种头孢类药物的残留量[J]. 食品科学, 2020, 41(2): 330-336. |
| [13] |
张小刚, 王霞, 戴春风, 等. QuEchers-超高效液相色谱-串联质谱法测定牛奶中6种头孢菌素类抗生素残留[J]. 色谱, 2018, 36(4): 345-350. |
| [14] |
崔凤云, 张朝晖, 李建辉, 等. 分散固相萃取-超高效液相色谱串联质谱法测定牛肉中7种头孢菌素类药物及其代谢物[J]. 食品安全质量检测学报, 2016, 7(2): 575-582. |
| [15] |
王军淋, 许娇娇, 蔡增轩, 等. 固相萃取富集-超高效液相色谱- 串联质谱法同时测定源水和自来水中的40种多类别抗生素[J]. 中国卫生检验杂志, 2016, 27(4): 417-420. |
| [16] |
万位宁, 陈熹, 居学海, 等. 固相萃取-超高效液相色谱串联质谱法同时检测禽畜粪便中多种抗生素残留[J]. 分析化学, 2013, 41(7): 993-999. |
| [17] |
梁倩文, 朱国婵, 郑超红, 等. 全自动固相萃取-液相色谱串联质谱法测定动物源性食品中53种常见兽药残留[J]. 食品安全质量检测学报, 2021, 12(10): 4161-4173. |
| [18] |
吉林省质量技术监督局. 生活饮用水及水源水中10种抗生素的检验方法超高效液相色谱-质谱/质谱法: DB 22/T 2838—2017[S]. 吉林: 吉林人民出版社, 2018.
|
| [19] |
柴蕊. 水体中头孢类抗生素降解及吸附效果的研究[D]. 阜新: 辽宁工业技术大学, 2019.
|
| [20] |
生态环境部. 环境监测分析方法标准制订技术导则: HJ 168—2020[S]. 北京: 中国环境出版集团, 2020.
|
 2024, Vol. 16
2024, Vol. 16 