有机氯农药因其性质稳定,不易分解,且具有生物累积性,是《关于持久性有机污染物的斯德哥尔摩公约》中优先控制的持久性有机污染物之一[1-3]。目前,尽管大部分的有机氯农药已被禁用多年,但由于其易残留,持久性强及难降解的特点,部分有机氯农药在农用地土壤中仍可检出,危害人类健康[4-5],因此,加强对环境中有机氯农药的监测十分必要。
由于土壤样品提取困难,基质复杂,因此选择简单高效的前处理方法与净化方法是土壤中有机物残留检测的重点。传统的前处理方法有索氏提取法、超声提取法等,具有萃取时间长、萃取效率低的缺点,而加速溶剂萃取法的萃取时间短,操作自动化程度高、萃取充分[6-7]。样品溶剂浓缩方法有氮吹浓缩和平行蒸发浓缩,氮吹浓缩时间长,溶剂不可回收,平行蒸发浓缩时间短,溶剂可以回收,对环境污染小。由于土壤样品基质复杂,会在气相色谱进样口衬管上形成活性位点,影响定量结果的准确性,因此提取样品必须进行净化,常见的净化方法有固相萃取小柱法和凝胶色谱法。固相萃取小柱是通过极性吸附达到分离的目的,操作简单,但是回收率较低,凝胶色谱法是通过分子尺寸大小进行分离[8],能可视化收集目标物,操作便捷,回收率较高。现采用全自动一体化前处理设备,优化了加速溶剂萃取条件和平行蒸发前处理条件,比较了凝胶净化色谱、硅胶柱、硅酸镁柱的净化效果,以期为农用地土壤中23种有机氯农药的检测提供参考。
1 实验部分 1.1 仪器与试剂仪器:7890B/7000D三重四极杆气相色谱-质谱联用仪(美国Agilent公司);HP-5MS毛细管柱(30.0 m×0.32 mm,膜厚0.25 μm,美国Agilent公司);Flex-HPSE快速压力溶剂萃取仪(北京莱伯泰科仪器股份有限公司);Sncore Analyst平行蒸发仪(上海步琦实验室设备贸易有限公司);PreElite-GC/U112020G-168全自动凝胶净化-定量浓缩联用仪(北京莱伯泰科仪器股份有限公司);Bio-Beads SX3凝胶净化色谱柱(20 mm×300 mm,北京莱伯泰科仪器股份有限公司)
试剂:23种有机氯标准贮备液(1.0 mg/L),四氯间二甲苯标准贮备液(替代物,1.0 mg/L),十氯联苯标准贮备液(替代物,1.0 mg/L),菲-d10标准贮备液(内标物,1.0 mg/L),以上贮备液溶剂均为正己烷,购于上海安谱实验科技股份有限公司;土壤中23种有机氯农药质控样(Lot Number:200520,美国NSI Lab Solutions公司);丙酮(色谱纯,上海安谱实验科技股份有限公司);正己烷(色谱纯,德国默克公司);石英砂、硅藻土、无水硫酸钠(分析纯,国药集团化学试剂有限公司),使用前置马弗炉中450 ℃烘烤4 h。
1.2 前处理方法 1.2.1 萃取土壤样品除去异物(石头、叶片等)后,称取20 g,加入一定量的硅藻土,充分混匀,在研钵中反复研磨成细小颗粒,充分拌匀后全部装进底部放有醋酸纤维滤膜的萃取池中填实。在萃取池上端,保留0.5~1.0 cm高的空间,若萃取池上端空间>1.0 cm,应加入适量石英砂。顶部放入醋酸纤维滤膜,拧紧顶盖,竖直平稳放入快速压力溶剂萃取仪中。快速压力溶剂萃取仪条件:载气压力为0.8 MPa,加热温度为100 ℃,萃取池压力为8.27×106~ 1.38×107 Pa,预加热平衡5 min,静态萃取5 min,溶剂淋洗体积为萃取池体积的20%。提取溶剂为丙酮/正己烷混合溶剂(V/V=1 ∶ 1),静态萃取2次,收集合并萃取液。
1.2.2 过滤和浓缩在砂芯漏斗中,加入适量纯化后的无水硫酸钠,将萃取液过滤到浓缩容器中。再用2~3 mL提取溶剂洗涤萃取收集瓶并冲洗漏斗,一并收集到浓缩容器中,放入平行蒸发仪进行浓缩。平行蒸发仪条件:温度为40 ℃,真空度为2.5×107 Pa,转速为250 r/min,将提取液浓缩至约1.0 mL。
1.2.3 净化-浓缩-定容将浓缩后的提取液经全自动凝胶净化-定量浓缩联用仪进行净化-浓缩-定容一体化处理。凝胶净化条件,紫外检测器波长为254 nm,淋洗液为环己烷/乙酸乙酯(V/V=1 ∶ 1),流量为5.0 mL/min,满环进样(5.0 mL),收集馏分14~24 min。同步在线定容浓缩条件:温度为40 ℃,定容加内标至1.0 mL。若样品基质比较干净,得到的提取液澄清透明无杂质,可忽略净化步骤,直接浓缩加内标至1.0 mL。
1.3 测定条件程序升温:初始温度120 ℃,保持2 min;以12 ℃/min升至180 ℃,保持5 min;以7 ℃/min升至240 ℃,保持1 min;以1 ℃/min升至250 ℃,保持4 min;进样口温度:250 ℃;质谱接口温度:280 ℃;离子源温度:230 ℃;载气:He(纯度>99.999%),1.0 mL/min(恒流);进样量:1.0 μL;进样方式:分流进样(分流比20 ∶ 1);电离方式:电子轰击源(EI);溶剂延迟:5.0 min;质谱扫描方式:选择离子模式(SIM)。目标化合物的定性、定量离子见表 1。
| 表 1 目标化合物的定性、定量离子 |
取一定量有机氯标准贮备液和替代物标准贮备液,配制不少于5个质量浓度的标准系列溶液,2种贮备液质量浓度分别为0.20,0.50,1.00,3.00,5.00,8.00,10.0 mg/L,添加的内标物质量浓度均为2.00 mg/L,贮存于棕色进样瓶中,依次由低质量浓度到高质量浓度进样分析。以目标化合物与内标物质量浓度的比值为横坐标,以目标化合物与内标物定量离子响应值的比值为纵坐标,绘制标准曲线。
1.5 标准谱图23种有机氯混合标准溶液(5.00 mg/L)的总离子流图见图 1。由图 1可见,各有机氯分离度良好,可以准确地进行定性与定量分析。
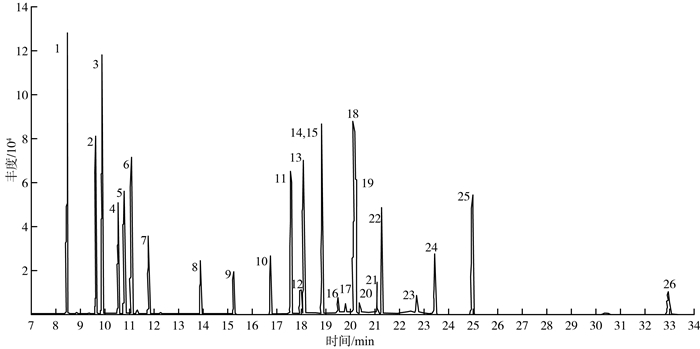
|
图 1 23种有机氯农药总离子流图 注:1—四氯间二甲苯;2—α-六六六;3—六氯苯;4—β-六六六;5—γ-六六六;6—δ-六六六;7—菲-d10;8—七氯;9—艾式剂;10—环氧化七氯;11—α-氯丹;12—α-硫丹;13—γ-氯丹;14—狄氏剂;15—p,p'-DDE;16—异狄氏剂;17—β-硫丹;18—p,p'-DDD;19—o,p'-DDT;20—异狄氏剂醛;21—硫丹硫酸酯;22—p,p'-DDT;23—异狄氏剂酮;24—甲氧滴滴涕;25—灭蚁灵;26—十氯联苯。 |
在不同的萃取溶剂及萃取循环次数条件下,对有机氯硅藻土进行加标回收实验,加标量为0.25 mg/kg,结果见图 2和图 3(化合物序号同表 1,下同)。
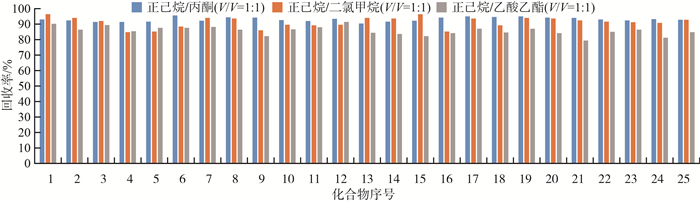
|
图 2 不同萃取溶剂对有机氯硅藻土加标回收率的影响 |

|
图 3 不同萃取次数对有机氯硅藻土加标回收率的影响 |
由图 2可见,3种萃取溶剂对23种有机氯的回收率都较高,但是正己烷/丙酮(V/V=1 ∶ 1)和正己烷/二氯甲烷(V/V=1 ∶ 1)优于正己烷/乙酸乙酯(V/V=1 ∶ 1)。正己烷/二氯甲烷在实际土壤检测中干扰杂峰较多,这是由于二氯甲烷的溶解性大于丙酮,在加速溶剂萃取过程中,会将土壤中更多的杂质萃取出来。因此选择正己烷/丙酮作为萃取溶剂。
由图 3可见,萃取1次的回收率较低,萃取2次和3次的回收率较高且接近。萃取2次时,23种有机氯已经达到萃取平衡,因此选择萃取2次作为实验条件。
2.2 平行蒸发条件选择在平行蒸发仪不同温度及真空度条件下,对空白溶剂[丙酮/正己烷(V/V=1 ∶ 1)]进行加标回收实验,加标量为0.25 mg/kg,结果见图 4和图 5。

|
图 4 平行蒸发仪不同温度对空白溶剂加标回收率的影响 |

|
图 5 平行蒸发仪不同真空度对空白溶剂加标回收率的影响 |
由图 4可见,平行蒸发仪温度对23种有机氯回收率的影响较小,温度40 ℃优于35与45 ℃。这是由于温度较低时,需要的浓缩时间较长,目标物质容易损失,回收率较低;温度较高时,需要的浓缩时间缩短,但是有机氯减压蒸馏时温度较高,易损失,因此选择平行蒸发温度为40 ℃。
在20 ℃时,正己烷的真空度为1.2×104 kPa,丙酮的真空度为1.8×104 kPa。由图 5可见,2.5×104 kPa恒压的回收率<2.0×104 kPa恒压的回收率,这是因为真空度较高时,溶剂难以蒸发,到达浓缩平衡的时间较长,目标物质容易损失;2.0×104 kPa恒压时,由于真空度接近丙酮的真空度,样品瓶中的溶液会形成爆沸,从而影响回收率;而在5 min内缓慢达到2.0×104 kPa,可防止溶液瓶内爆沸,2.0×104 kPa的真空度也能保证23种有机氯有较高的回收率。
2.3 净化方法对比考察硅胶柱、硅酸镁柱、凝胶净化色谱对有机氯的净化效果,对其进行加标回收实验,加标量为0.25 mg/kg,结果见图 6。由图 6可见,凝胶净化色谱的回收率为87.0%~101%,硅胶柱的回收率为61.0%~75.0%,硅酸镁柱的回收率为63.0%~84.0%。可见凝胶净化色谱净化效果优于硅胶柱与硅酸镁柱,因此选用凝胶净化色谱作为净化方法。

|
图 6 3种净化方法对23种有机氯空白加标回收率的影响 |
按1.4节进行标准系列溶液的配制,按《环境监测分析方法标准制修订技术导则》(HJ 168—2020)进行检出限测定[9],对实际农用地土壤进行6次重复加标实验,加标量为0.25 mg/kg,结果见表 2。在土壤基质中,23种有机氯农药的方法检出限为0.003 4~0.005 2 mg/kg,满足《土壤和沉积物有机氯农药的测定气相色谱-质谱法》(HJ 835—2017)要求[10];23种有机氯农药的加标回收率为82.0%~93.7%,相对标准偏差(RSD)≤8.7%,说明方法的准确度和精密度良好。
| 表 2 校准曲线、检出限和回收率结果(n=6) |
对土壤标准有证质控样进行测定,结果见表 3。由表 3可见,土壤中23种有机氯农药质控样的测定值均在验收范围之内,说明该方法准确度良好。
| 表 3 土壤有证标准质控样品测定结果 |
建立了加速溶剂萃取-凝胶净化色谱-气相色谱质谱法测定农用地土壤中23种有机氯农药的检测方法。该方法使用全自动一体化前处理设备,并对样品前处理进行了条件优化,使前处理过程更加快速、高效,是对已有土壤有机氯国标检测方法的优化与补充。基质加标回收实验等方法学验证,得到了一系列令人满意的结果,23种有机氯农药加标回收率为82.0%~93.7%,RSD≤8.7%,土壤中23种有机氯农药质控样的测定值均在验收范围之内,表明方法准确可靠,适用于农用地土壤中有机氯农药残留的痕量分析。
| [1] |
朱洁羽, 王栋, 王远坤, 等. 太湖流域持久性有机污染物特征分析和生态与健康风险评价[J]. 南京大学学报(自然科学), 2016, 52(2): 370-381. |
| [2] |
欧阳敏, 喻庆国, 赵晓慧, 等. 剑湖沉积物中有机氯农药的分布特征与风险评估[J]. 环境科学学报, 2019, 39(12): 4075-4087. |
| [3] |
ATMACA E, DAS Y K, YAVUZ O, et al. An evaluation of the levels of organochlorine compounds(OCPs and PCBs) in cultured freshwater and wild sea fish eggs as an exposure biomarkerforenvironmental contamination[J]. Environmental Science and Pollution Research, 2019, 26(7): 7005. DOI:10.1007/s11356-019-04207-0 |
| [4] |
杨代凤, 刘腾飞, 谢修庆, 等. 我国农业土壤中持久性有机氯类农药污染现状分析[J]. 环境与可持续发展, 2017, 42(4): 40-43. |
| [5] |
代敏, 李东旭, 林诗云, 等. 气相色谱-质谱法测定土壤中多环芳烃及有机氯农药[J]. 环境科学导刊, 2020, 39(2): 90-97. |
| [6] |
朱小梅, 张颖, 吴晶. 土壤中16种多环芳烃和8种有机氯农药的前处理方法研究[J]. 广东化工, 2021, 48(6): 147-149. |
| [7] |
魏丹, 国明, 吴慧珍, 等. 加速溶剂萃取-磁固相萃取净化-气相色谱-质谱法测定土壤中16种多环芳烃和23种有机氯残留[J]. 色谱, 2020, 38(8): 945-952. |
| [8] |
张会强, 王斐, 张秦铭, 等. 气相色谱法测定土壤中有机氯农药净化条件的对比研究[J]. 陕西农业科学, 2020, 66(12): 12-14. |
| [9] |
中华人民共和国环境保护部. 环境监测分析方法标准制修订技术导则: HJ 168—2010[S]. 北京: 中国环境科学出版社, 2010.
|
| [10] |
中华人民共和国环境保护部. 土壤和沉积物有机氯农药的测定气相色谱-质谱法: HJ 835—2017[S]. 北京: 中国环境科学出版社, 2017.
|
 2024, Vol. 16
2024, Vol. 16 