2. 中国地质大学(武汉),湖北 武汉 430074;
3. 湖北省地质实验测试中心,湖北 武汉 430034;
4. 资源与生态环境地质湖北省重点实验室(湖北省地质局),湖北 武汉 430034
2. China University of Geosciences(Wuhan), Wuhan, Hubei 430074, China;
3. Hubei Province Geological Experimental Testing Center, Wuhan, Hubei 430034, China;
4. Hubei Key Laboratory of Resources and Eco-environment Geology(Hubei Geological Bureau), Wuhan, Hubei 430034, China
全氟羧酸(PFCs)是一类新兴的有机污染物,在过去的70年里,PFCs因其化学惰性、表面活性、耐热性及疏水、疏油等特性被广泛用于化学品中[1-2],因此每年有数量巨大的PFCs产生。PFCs普遍具有很高的化学及物理稳定性,在环境介质中具有很长的生物半衰期和很强的生物累积性[3],对动物体具有多种危害毒性,会造成肝脏损伤,影响发育和生殖,并具有免疫毒性,干扰内分泌系统,具有潜在的致癌性等[4]。因此这类化合物成为了全球性的污染物质,并已被列为我国生态环境部发布的《生态环境监测规划纲要(2020—2035年)》中的重点监测对象。目前,对PFCs的测定方法以针对人体[5-8]、纺织品[9-10]、食品[11-12]和水体[13-14]中的居多,针对土壤中的分析方法报道较少,尤其是低碳、无二次污染的分析方法鲜有报道。王懿等[15]利用甲醇溶剂-加速萃取-超高效液相色谱串联质谱法对土壤中的PFCs进行了测定;谢琳娜等[16]利用氨水甲醇溶液超声萃取-固相萃取提取土壤中的PFCs;陈勇杰等[17]建立了乙腈溶剂在高温、高压下萃取土壤和污泥中多种PFCs的检测方法。上述方法均是使用极性较强的有机溶剂提取土壤中的PFCs。
1994年,Hawthorne等[18]首次在加速溶剂萃取法中将水作为溶剂用来提取多环芳烃。研究表明,随着温度的升高,水的介电常数下降(极性变小),导致水的黏度、表面张力降低,从而增大了水的扩散系数,提高了萃取目标物的能力。之后越来越多的学者开始关注水这种无毒无害的溶剂,并开发了一系列以水为提取剂的加速溶剂萃取方法,用于提取生物活性成分、抗生素、杀虫剂等[19-23]。现以水为提取剂,结合固相萃取技术,使用超高效液相色谱串联质谱法,建立一种土壤中痕量PFCs的分析方法,为环境样品中PFCs等极性化合物的分析提供新的思路。
1 材料与方法 1.1 仪器与试剂仪器:ASE350加速溶剂萃取仪(美国Thermo Fisher公司);3K15型台式高速冷冻离心机(德国西格玛科技有限公司);Biotage Turbo VapII全自动定量浓缩仪(瑞典BUCHI公司);Milli-Q Direct 8纯水/超纯水一体化系统(美国Millipore公司);PHS-25 pH计(上海仪电科学仪器股份有限公司);CNW 24位固相萃取真空装置(上海安谱实验科技股份有限公司);Waters ACQUITY UPLC BEH C18色谱柱(2.1 mm ×50 mm,1.7 μm,美国Waters公司);CNW-PWAX固相萃取小柱(500 mg/6 mL,上海安谱实验科技股份有限公司);聚烯烃滤膜(0.22 μm,上海安谱实验科技股份有限公司)。
试剂:全氟丙酸、全氟丁酸、全氟戊酸、全氟己酸、全氟庚酸、全氟辛酸(均为固体,纯度均≥99%,德国Dr. Ehrenstorfer公司);甲醇(色谱纯),氨水(30%,分析纯),甲酸(98%,色谱纯),乙酸铵(98%,色谱纯),均购于美国Fisher公司;石英砂、氢氧化钠、盐酸(均为分析纯,天津市大茂化学试剂厂)。
1.2 实际样品选取湖北几处全氟羧酸的背景土壤(水稻土、潮土、黄棕壤等)开展样品加标研究,土壤样品为弱酸性接近中性,有机质质量分数为1~100 g/kg范围。样品采集后冷冻干燥,研磨过筛(80~100目),保存在PP材质密封袋中,于-20 ℃下冷冻保存。
1.3 实验方法 1.3.1 标准溶液配制先将PFCs固体标准品分别用超纯水溶解,配制成1 000 mg/L的标准储备液;然后用超纯水稀释,配制成混合标准储备溶液(全氟丙酸、全氟丁酸和全氟戊酸质量浓度为100 mg/L,全氟己酸、全氟庚酸和全氟辛酸质量浓度为10 mg/L);于2~10 ℃避光保存。使用时,用甲醇水溶液(V ∶ V=1 ∶ 4)根据需要稀释成不同质量浓度的标准工作溶液,冷藏避光保存。
1.3.2 加速溶剂萃取过程选已制备好的黄棕壤样品;准确称取5.00 g放于研钵中,加入约3.00 g硅藻土,研磨混匀,装于底层铺有一层石英砂的萃取池中,加入200 μL的甲酸后,再加入适量的石英砂至略低于池口。萃取溶剂为超纯水,萃取压力为10 342 kPa,萃取温度为100 ℃,静态时间为5 min,循环次数为3次,吹扫体积为60%,吹扫时间为60 s,收集的萃取液待净化。
1.3.3 样品净化依次使用6 mL甲醇和超纯水分别活化固相萃取小柱,保证柱头润湿,取萃取液用氨水调节pH值为9~11,经过滤纸过滤后,以5 mL/min的流速通过小柱。上样完毕后,用5 mL的甲醇水溶液(5%)淋洗小柱,使用真空泵抽滤小柱2 min,放置干燥5 min;再使用10 mL的氨水甲醇溶液(5%)润湿小柱,平衡5 min后,以2~3 mL/min的流速收集洗脱液。
1.3.4 样品浓缩将洗脱液转入浓缩管中,在水浴温度为45 ℃和氮气压力为48.27~68.95 kPa条件下浓缩,浓缩过程中使用少量甲醇淋洗浓缩管壁,如此重复1~2次。浓缩至液面约为0.50 mL刻度线,用超纯水定容至2 mL,混匀后经聚烯烃过滤头过滤,待上机测试。
1.4 仪器条件色谱柱柱温:45 ℃;流动相A:2 mmol/L的乙酸铵水溶液;流动相B:甲醇溶液;流速:0.4 mL/min;进样体积:5 μL;梯度洗脱程序:初始比例20% B,在0.5 min内升高至25%,在4.5 min内升高至95%,保持0.5 min,在0.5 min内降为20%;离子源:电喷雾离子源(ESI);扫描方式:负离子模式;离子源温度:150 ℃;毛细管电压:3.00 kV;脱溶剂气温度:500 ℃;脱溶剂气流速:1 000 L/h;喷雾气压力:700 kPa;监测模式:多反应监测(MRM)。PFCs目标化合物质谱参数见表 1。
| 表 1 PFCs目标化合物质谱参数 |
在实验分析中,聚四氟乙烯等材质的实验器皿会引入PFCs物质,导致样品背景值升高;此外玻璃材质和聚醚砜等新型有机材料的滤膜会对PFCs有吸附作用。为保证实验质量,将样品前处理过程中使用的进样小瓶、试管等器皿均替换为聚丙烯材质;将其可能接触到的玻璃材质如氮吹管、接收管等均做了空白及吸附测试。在对不同材质的滤头进行实验中发现,尼龙材质对6种PFCs均具有较强的吸附作用,聚醚砜材质的滤膜对全氟庚酸、全氟己酸和全氟辛酸有吸附作用,聚烯烃材质的滤膜无吸附作用,因此选择聚烯烃滤膜。
2 结果与讨论 2.1 色谱条件的优化 2.1.1 流动相体系的选择PFCs属于酸性化合物,本实验选用Waters ACQUITY UPLC BEH C18色谱柱实现这类物质的分离,并采用负离子模式进行扫描。考察了乙腈/水溶液、乙腈/乙酸铵水溶液、甲醇/水溶液和甲醇/乙酸铵水溶液4种流动相体系对目标物色谱行为的影响。结果表明,选用甲醇作为流动相时,所有组分的保留时间增加,并提高了目标物的分离度;而选用乙腈作为流动相时,目标物质谱响应的稳定性较差。因此,选用甲醇作为流动相B。在流动相中加入乙酸铵时,质谱信号响应呈增强的趋势,进一步考察了乙酸铵的添加浓度(0,0.5,1.0,2.0,5.0,10.0 mmol/L)对PFCs质谱信号的影响。结果表明,随着乙酸铵加入浓度的增加,全氟辛酸质谱信号受影响较大,在2.0 mmol/L时响应最强,进一步增加乙酸铵浓度,质谱信号响应显著下降。因此,选择2.0 mmol/L乙酸铵水溶液作为流动相A,此时6种PFCs的色谱行为和质谱响应为最优。
2.1.2 进样溶液的选择为研究进样溶液对PFCs测定的影响,分别采用甲醇/水体积比为0 ∶ 100,10 ∶ 90,20 ∶ 80,50 ∶ 50,70 ∶ 30,90 ∶ 10,100 ∶ 0的溶液配制标准溶液样品,进行多次重复进样分析。结果发现,全氟丙酸和全氟丁酸的峰形受进样溶液组成影响较大,当溶液比例接近初始流动相时,其受影响的目标化合物峰形更加对称尖锐,随着甲醇比例增大,峰出现拖尾、展宽甚至双头峰等色谱行为,且在进样体积>5 μL后色谱行为尤为明显。为了同时得到较优的目标物色谱峰形和较低的方法检出限,须控制较低的甲醇比例,从而使得浓缩时间较长或要进行稀释,这又会影响目标物的回收率和方法检出限。综上考虑,选择甲醇/水体积比为20 ∶ 80的溶液作为进样溶液,上样体积为5 μL。在优化仪器参数的工作条件下,质量浓度5.0 μg/L的全氟丙酸、全氟丁酸和全氟戊酸,质量浓度为0.50 μg/L的全氟己酸、全氟庚酸和全氟辛酸的标准溶液的色谱图见图 1(化合物序号同表 1,下同)。由图 1可见,目标物峰形对称且尖锐,分离效果良好。
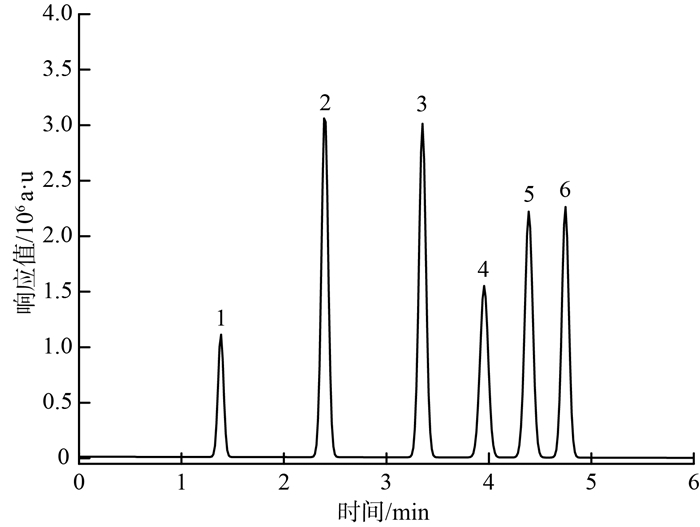
|
图 1 6种PFCs的色谱图 |
PFCs碳氟链上的氟具有较强的电负性,使其主要通过氢键作用和静电作用等吸附于土壤颗粒上,与土壤某些离子形成作用力较强的配位键,因此土壤的含盐量、pH值及阳离子交换量等理化性质会对土壤中全氟羧酸的萃取产生一定的影响。为提高纯水溶剂的萃取回收率,通过在纯水和萃取池中加入少量溶于水的有机试剂,发现加入的少量有机溶剂会与水溶剂发生分层现象,使萃取仪稳定性下降,发生堵塞。
制备样品时添加一些乙二胺四乙酸(EDTA)、EDTA二钠或柠檬酸钠等试剂,也易发生堵塞,使萃取液浑浊。导致上述问题的原因是添加有机试剂或无机盐后,随着萃取液温度的变化,加剧了水溶剂中一些物质的盐析和盐溶效应,从而使萃取仪堵塞,导致出现萃取不稳定的问题。
在萃取池中加入50,100,200 μL的甲酸或氨水溶液,考察其对PFCs回收率的影响,结果见图 2。由图 2可见,加入200 μL的甲酸或氨水时,回收率整体最好,但因为加入氨水后获取的萃取液颜色较深且较为浑浊,故选择加入200 μL的甲酸。
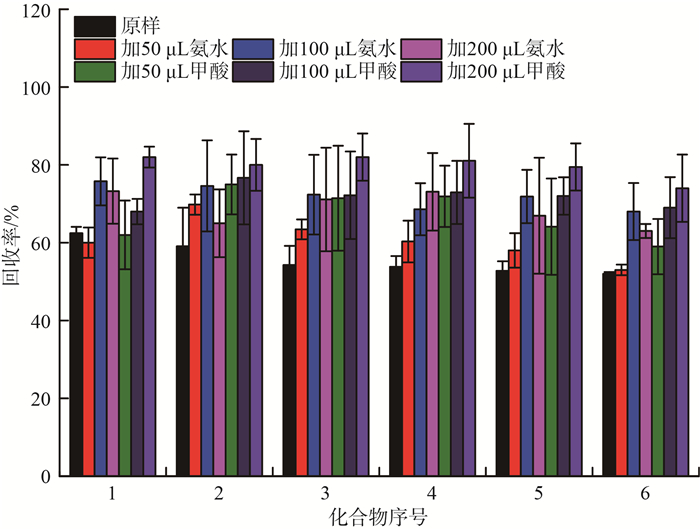
|
图 2 不同萃取剂对PFCs回收率的影响 |
提高萃取温度能增加PFCs在水溶剂中的溶解度,也能减小溶剂进入土壤基质中的阻滞作用,减弱目标化合物与土壤间的相互作用力,是提高水溶剂萃取效率的主要因素。通过样品加标实验,考察萃取温度为60,80,100,120和150 ℃时的萃取回收率,结果见图 3。由图 3可见,当萃取温度为100和120 ℃时,目标物的回收率整体>69.7%;当萃取温度为150 ℃时,提取液中的共萃物明显增多,导致基质效应增强,回收率有显著下降趋势。综合考虑,选择100 ℃作为萃取温度。
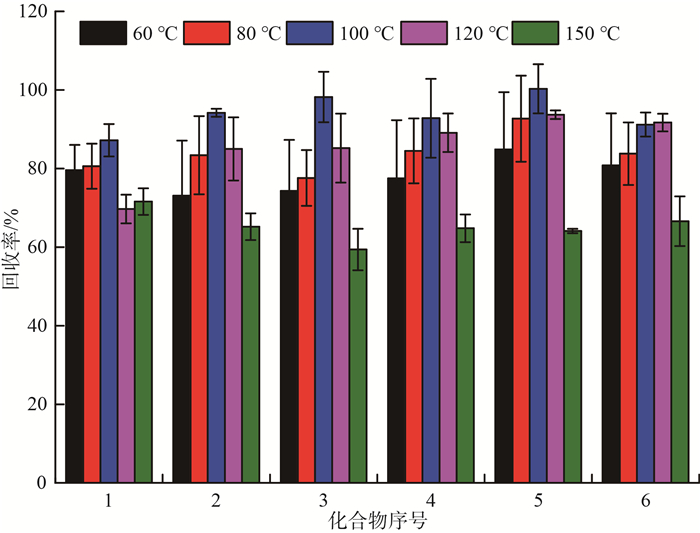
|
图 3 不同萃取温度对PFCs回收率的影响 |
静态萃取时间直接决定水溶剂萃取土壤时间的长短,考察了静态萃取时间为5,10,15 min时萃取回收率,结果见图 4。由图 4可见,随着静态萃取时间的增加,回收率总体呈现下降趋势。随着萃取时间的增加,萃取液颜色变深,说明共萃取杂质的浓度增高,从而导致进样的基质效应增强,回收率降低。因此,选择静态萃取5 min为最佳时间。
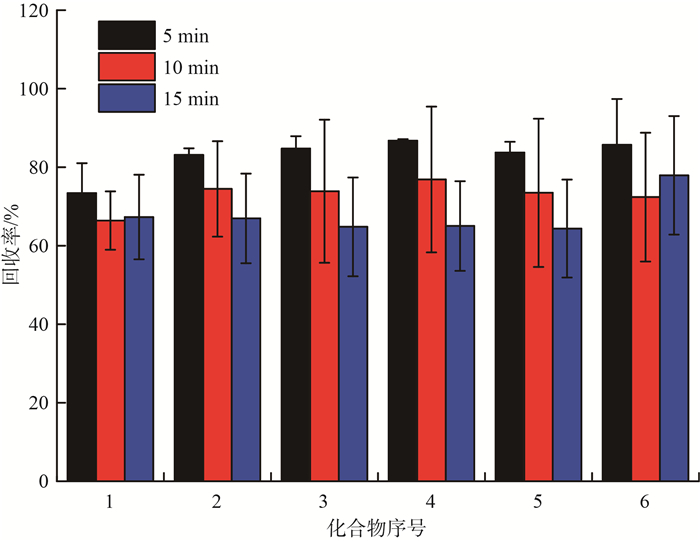
|
图 4 不同静态萃取时间对PFCs回收率的影响 |
考察了萃取循环次数为1,2和3次对样品萃取回收率的影响,结果见图 5。由图 5可见,随着萃取次数的增加,水溶剂对PFCs的提取效果增长趋势明显,萃取循环3次的回收率为87.2%~100%。因此,选择萃取循环次数为3次。

|
图 5 不同萃取循环次数对PFCs回收率的影响 |
影响固相萃取法效果的因素主要包括固相萃取小柱的选择、上样溶剂的pH值和洗脱溶剂等因素。根据李飞等[24]和王超等[25]的研究可知,选择弱阴离子交换柱作为萃取水中PFCs的小柱,采用适当比例的氨水甲醇作为洗脱剂均能取得较好的回收率。因此,选择弱阴离子交换柱CNW-PWAX固相萃取小柱进行实验。为了筛选出合适的上样溶剂的pH值和洗脱溶剂,分别用氢氧化钠和盐酸调节样品萃取液的pH值为3,5,7,9,11,加入定量的标液后,参考1.3.2节进行样品处理,考察不同pH值对样品回收率的影响,结果见图 6。由图 6可见,全氟丙酸和全氟丁酸在pH值为3~11时主要靠萃取小柱的离子交换能力保留,均有良好的回收率。而全氟戊酸、全氟己酸、全氟庚酸和全氟辛酸化合物的回收率随着pH值的提高有显著的增加趋势。可能是因为水溶剂萃取土壤样品时,萃取液中含有的部分杂质(腐殖酸和金属离子等)与目标化合物相互作用,抑制了PFCs的完全电离,而提高pH值更有利于目标化合物的电离,从而通过离子交换作用保留在小柱上。因此,选择pH值为9~11作为净化溶液的上样条件。
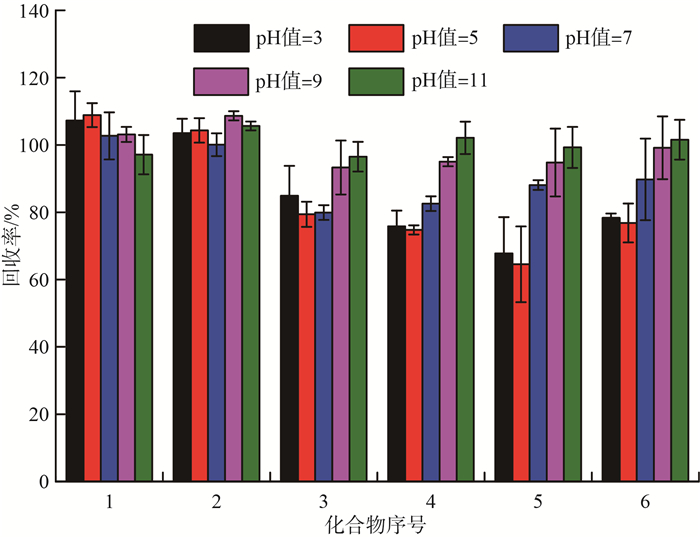
|
图 6 不同pH值对萃取小柱富集回收率的影响 |
因为萃取小柱上的基团与分析物PFCs之间会产生阴离子交换作用和次级作用,选择10 mL体积分数分别为2%和5%的氨水(溶剂为甲醇)进行洗脱,考察其对PFCs回收率的影响,结果见图 7。由图 7可见,10 mL 5%的氨水能完全洗脱目标化合物,回收率为97.7%~103%。因此,选择5%的氨水溶液作为洗脱条件。
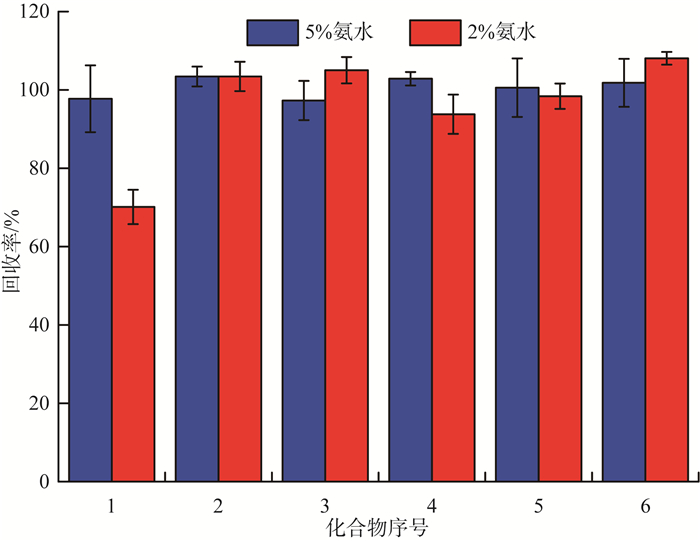
|
图 7 不同洗脱剂对PFCs回收率的影响 |
通常可以通过调节氮吹浓缩设备的水浴温度来实现目标化合物的快速高效浓缩。浓缩条件对PFCs回收率的影响见图 8。由图 8可见,当浓缩体积为1 mL时,目标化合物的整体回收率在45 ℃时最优;在水浴温度为45 ℃时,继续探究从1 mL浓缩至近干时目标化合物的回收率,结果发现其变化趋势不明显。因此,综合考虑进样溶剂的因素,选择水浴温度45 ℃浓缩至近干,用超纯水定容至2 mL。
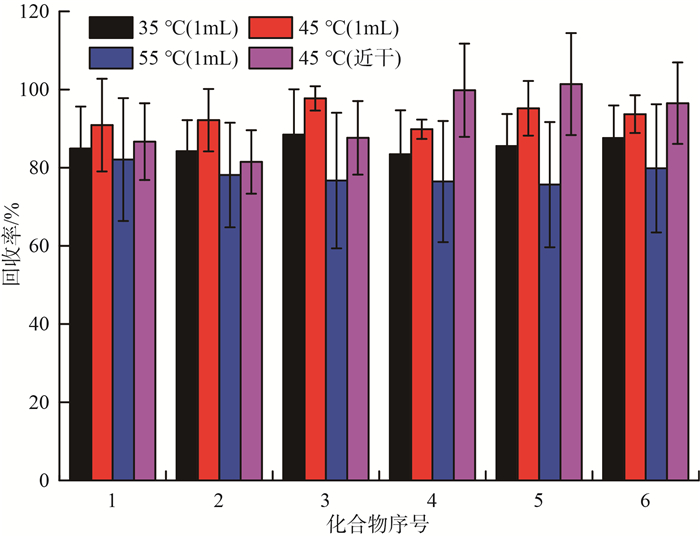
|
图 8 不同浓缩条件对PFCs回收率的影响 |
配制6种PFCs混合溶液的标准溶液,其中全氟丙酸、全氟丁酸和全氟戊酸的质量浓度分别为0.5,1.0,5.0,20.0,50.0,100 μg/L,全氟己酸、全氟庚酸和全氟辛酸的质量浓度分别为0.05,0.1,0.5,2.0,5.0,10.0 μg/L,以6种PFCs的体积分数为横坐标(x),对应的色谱峰面积为纵坐标(y),绘制得到线性方程及相关系数(r)。按照《环境监测分析方法标准制订技术导则》(HJ 168—2020)规定[26],连续测定7个接近预期方法检出限的实验室空白加标样品,利用测定值的标准偏差计算方法检出限,得到6种PFCs的方法检出限为0.03~0.4 μg/kg,利用4倍检出限计算得到定量下限,为0.12~1.6 μg/kg。6种PFCs的线性范围、线性方程、相关系数、检出限和定量下限见表 2。
| 表 2 6种PFCs的线性方程、相关系数(r)、检出限和定量下限 |
为进一步考察本方法对土壤测定的适用性,对某农田实际土壤样品中的PFCs进行测定,结果表明土壤的PFCs本底值均小于方法检出限。对土壤样品进行低、中和高3个质量分数水平的基体加标实验,其中全氟丙酸、全氟丁酸和全氟戊酸的加标质量分数分别为4,40和80 μg/kg,全氟己酸、全氟庚酸和全氟辛酸的加标质量分数分别为0.4,4和8 μg/kg,平行测定6次,计算样品的加标回收率和相对标准偏差(RSD),结果见表 3。由表 3可见,6种PFCs的平均加标回收率为90.7%~118%,RSD为5.6%~18.0%,表明方法的精密度和准确度均能满足土壤中PFCs检测的要求。
| 表 3 土壤样品中PFCs的加标回收率及相对标准偏差(n=6) |
在优化前处理步骤和仪器分析方法的基础上,建立了一种水溶剂加速萃取-超高效液相色谱串联质谱测定土壤中PFCs的方法。结果表明,此方法对实际土壤样品进行测定,低、中、高质量分数加标实验的平均回收率为90.7%~118%,RSD为5.6%~18.0%,其精密度和准确度均较好;方法检出限为0.03~0.4 μg/kg,能够满足土壤中痕量PFCs的测定。该方法前处理过程简单、易操作,仪器检测效率高,结果准确,全过程以水为提取溶剂,不仅为可应用于土壤中PFCs的测定,也为其他极性有机污染物的检测提供了参考。
| [1] |
周庆, 张满成, 卢宇飞, 等. 全氟类化合物的检测与治理研究进展[J]. 环境科学与技术, 2008, 31(7): 44-52. |
| [2] |
黄家浩, 吴玮, 黄天寅, 等. 骆马湖表层水和沉积物中全氟羧酸赋存特征、来源及健康风险评估[J]. 环境科学, 2022, 43(7): 3562-3574. |
| [3] |
LINDSTROM A B, STRYNAR M J, LIBELO E L. Polyfluorinated compounds: Past, present, and future[J]. Environmental Science & Technology, 2011, 45: 7954-7961. |
| [4] |
KENNEDY G J, BUTENHOFF J L, OLSEN G W, et al. The toxicology of perfluorooctanoate[J]. Critical Reviews Toxicology, 2004, 34: 351-384. DOI:10.1080/10408440490464705 |
| [5] |
姚谦, 田英. 中国人群全氟羧酸健康风险评估研究进展[J]. 上海交通大学学报(医学版), 2021, 41(6): 803-808. |
| [6] |
侯沙沙, 朱会卷, 谢琳娜, 等. 人体内全氟羧酸的暴露水平研究进展[J]. 环境卫生学杂志, 2020, 10(2): 218-225. |
| [7] |
KIM D H, LEE M Y, OH J E. Perfluorinated compounds in serum and urine samples from children aged 5-13 years in South Korea[J]. Environmental Pollution, 2014, 192(9): 171-178. |
| [8] |
朱永乐, 汤家喜, 李梦雪, 等. 全氟羧酸污染现状及与有机污染物联合毒性研究进展[J]. 生态毒理学报, 2021, 16(2): 86-99. |
| [9] |
王春兰, 张海煊, 朱丽, 等. 气相色谱-三重四极杆质谱法同时测定纺织品中11种挥发性全氟羧酸前体物[J]. 色谱, 2021, 39(11): 1239-1246. |
| [10] |
刘葳. 纺织品中全氟羧酸检测技术研究[D]. 江门: 五邑大学, 2016.
|
| [11] |
王晶, 张子豪, 麦晓霞, 等. 高效液相色谱-串联质谱法测定食品接触材料及制品中27种全氟羧酸迁移量[J]. 分析测试学报, 2018, 37(5): 570-575. |
| [12] |
王飞, 李晓明, 李建勇. 食品中全氟羧酸的检测技术研究进展[J]. 食品安全质量检测学报, 2016, 7(5): 1963-1968. |
| [13] |
孙 㑇琳, 张欢燕, 周亚康. 高效液相色谱串联质谱法测定某市污水处理厂进出水中的全氟化合物[J]. 环境监控与预警, 2020, 12(5): 87-92. |
| [14] |
刘承友, 刘金林, 郭婧, 等. 大伙房水库多介质中全氟化合物赋存特征、源解析及健康风险评估[J]. 环境监控与预警, 2022, 14(5): 133-142. |
| [15] |
王懿, 孔德洋, 单正军, 等. 加速溶剂萃取-固相萃取净化-超高效液相色谱串联质谱法测定土壤中11种全氟羧酸[J]. 环境化学, 2012, 31(1): 113-119. |
| [16] |
谢琳娜, 张海婧, 侯沙沙, 等. 固相萃取-超高效液相色谱-串联质谱法分析土壤中15种全氟羧酸[J]. 分析化学, 2019, 47(12): 1967-1972. |
| [17] |
陈勇杰, 张蓓蓓, 陈国松, 等. 超高效液相色谱-串联质谱法测定污水和污泥基质中的20种全氟及多氟化合物[J]. 分析化学, 2019, 47(4): 533-540. |
| [18] |
HAWTHORNE S B, MILLER D J. Direct comparison of soxhlet and low-temperature and high-temperature supercritical CO2 extraction efficiencies of organics from environmental solids[J]. Analytical Chemistry, 1994, 66: 4005-4012. DOI:10.1021/ac00094a024 |
| [19] |
TEO C C, TAN S N, YONG J W H, et al. Evaluation of the extraction efficiency of thermally labile bioactive compounds in Gastrodia elata Blume by pressurized Hot water extraction and microwave-assisted extraction[J]. Journal of Chromatography A, 2008, 1182: 34-40. DOI:10.1016/j.chroma.2008.01.011 |
| [20] |
BOGIALLI S, CURINI R, CORCIA A D, et al. Simple and rapid assay for analyzing residues of carbamate insecticides in bovine milk: Hot water extraction followed by liquid chromatography-mass spectrometry[J]. Journal of Chromatography A, 2004, 1054: 351-357. DOI:10.1016/j.chroma.2004.04.014 |
| [21] |
FONT G, JUAN-GARCÍA A, PICÓ Y. Pressurized liquid extraction combined with capillary electrophoresis-mass spectrometry as an improved methodology for the determination of sulfonamide residues in meat[J]. Journal of Chromatography A, 2007, 1159: 233-241. DOI:10.1016/j.chroma.2007.03.062 |
| [22] |
KIM W J, KIM J, VERIANSYAH B, et al. Extraction of bioactive components from Centella asiatica usingsubcritical water[J]. Journal of Supercritical Fluids, 2009, 48: 211-216. DOI:10.1016/j.supflu.2008.11.007 |
| [23] |
李利荣, 吴宇峰, 时庭锐, 等. 固相萃取技术在环境水质监测方法开发中的应用[J]. 环境科学与技术, 2007, 30(3): 41-44, 117. |
| [24] |
李飞, 张超杰, 曲燕, 等. 污水中短长链全氟羧酸检测方法的开发[J]. 环境科学, 2009, 30(9): 2647-2654. |
| [25] |
王超, 吕怡兵, 陈海君, 等. 固相萃取-液相色谱-串联质谱法同时测定水中14种短链和长链全氟羧酸[J]. 色谱, 2014, 32(9): 919-925. |
| [26] |
生态环境部. 环境监测分析方法标准制订技术导则: HJ 168—2020[S]. 北京: 中国标准出版社, 2020.
|
 2024, Vol. 16
2024, Vol. 16 

