2. 江苏省环境监测中心,江苏 南京 210019
2. Jiangsu Provincial Environmental Monitoring Center, Nanjing, Jiangsu 210019, China
多环芳烃(PAHs)是指2个以上苯环以稠环形式相连的化合物,是一类在环境介质中广泛存在的致癌物[1-2]。卤代多环芳烃(HPAHs)是PAHs的卤代衍生物,主要包括氯代多环芳烃(Cl-PAHs)和溴代多环芳烃(Br-PAHs)。大部分HPAHs的毒性相较于母体PAHs高出几倍甚至几百倍[3],且具有半挥发性和生物累积性,是一类新型持久性有机污染物(POPs)。
环境中的PAHs和HPAHs主要来源于人类活动和自然过程,其中,人为源贡献更大,包括汽车尾气、有机物焚烧以及一些工业过程[4]。排放到空气中的PAHs在光照条件下会发生光化学反应,生成HPAHs[5]。PAHs和HPAHs会通过沉降或径流等途径进入地表水体,最终进入海洋,海洋中富含丰富的卤素离子,为形成HPAHs提供了有利条件[6-7]。除此以外,有研究表明,PAHs和HPAHs普遍存在于水源水和自来水中,即使水源水中PAHs质量浓度较低(0.01~10 ng/L),氯化消毒后仍然有可能形成Cl-PAHs,会对人体健康造成潜在风险[8-10]。由于水源水中溴离子(Br-)普遍存在,次氯酸(HOCl)有可能与Br-反应生成次溴酸(HOBr)[11-12],进而产生Br-PAHs[13]。
饮用水安全直接关系到人类健康和社会的稳定发展,是各国关注的焦点之一[14]。目前大多数研究都集中在空气[15-16]、沉积物[17-18]、土壤[19-20]、水[21]等环境介质中的PAHs及其危害,对HPAHs关注度较少,尤其是饮用水中的HPAHs。所以有必要探究HPAHs在饮用水处理过程中的变化趋势和组成特征。本研究选择了以长江、三河、太湖为水源水的3个自来水作为研究对象,对饮用水处理各工艺段出水中的PAHs和HPAHs进行了分析。探究了PAHs和HPAHs的污染水平和来源,评价了水厂处理工艺对不同水源水中目标污染物的去除效果,并计算出水中污染物对人体产生的潜在健康风险,旨在为饮用水安全评价,改进饮用水处理工艺提供科学依据和数据支撑。
1 实验部分 1.1 仪器与试剂真空泵(SHZ-DIII,予华仪器有限责任公司);0.45 μm玻璃纤维滤膜(津腾实验设备有限公司);SupelcleanTMLC-18固相萃取柱(500 mg,6 mL);氮吹仪(XT-NS 1,美国Organomation公司);气相色谱-质谱联用仪(Trace-ISQ,Thermo)。
16种PAHs标样:萘(Nap)、苊烯(Acy)、苊(Ace)、芴(Flu)、菲(Phe)、蒽(Ant)、荧蒽(Flt)、芘(Pyr)、苯并[a]蒽(BaA)、屈(Chry)、苯并[b]荧蒽(BbF)、苯并[k]荧蒽(BkF)、苯并[a]芘(BaP)、茚并[1,2,3-cd]芘(Ipy)、二苯并[a,h]蒽(DBA)、苯并[g,h,i]苝(BPE);9种Cl-PAHs标样:5-氯苊(5-Cl-Ace)、9,9-二氯芴(9,9-diCl-Flu)、9-氯菲(9-Cl-Phe)、2-氯蒽(2-Cl-Ant)、9-氯蒽(9-Cl-Ant)、9,10-二氯蒽(9,10-diCl-Ant)、9,10-二氯菲(9,10-diCl-Phe)、3-氯荧蒽(3-Cl-Flt)、6-氯苯并[a]芘(6-Cl-BaP);10种Br-PAHs标样:5-溴苊(5-Br-Ace)、2-溴芴(2-Br-Flu)、9-溴菲(9-Br-Phe)、2-溴蒽(2-Br-Ant)、9-溴蒽(9-Br-Ant)、2,7-二溴芴(2,7-diBr-Flu)、3-溴荧蒽(3-Br-Flt)、9,10-二溴蒽(9,10-diBr-Ant)、1-溴芘(1-Br-Pyr)、7-溴苯并[a]蒽(7-Br-BaA);内标物(菲-d10、屈-d12),替代物(2-氟联苯、对三联苯-d14)购自美国AccuStandard公司;甲醇(色谱纯,美国Merck公司);正己烷(色谱纯,美国Fisher公司);二氯甲烷(色谱纯,美国Fisher公司);无水硫酸钠。
1.2 样品采集与前处理分别于2023年7—8月(丰水期)和2024年1月(枯水期)对A水厂(以长江为水源)、B水厂(以三河为水源)、C水厂(以太湖为水源)进行全工艺流程采样。A、B水厂有原水、沉淀池、炭滤池、砂滤池、出水5个工艺流程。C水厂有原水、加氯原水、预臭氧池、生物氧化池、沉淀池、砂滤池、炭滤池、出水等8个工艺流程。
每个采样点采集4 L水样,分别装入2 L琥珀色玻璃瓶中,所有水样加入20 ng/L的2-氟联苯和对三联苯-d14的混合溶液作为替代物,在24 h内进行固相萃取。依次用6 mL二氯甲烷、甲醇、超纯水对固相萃取柱进行活化,水样以12 mL/min的速度通过固相萃取柱,萃取结束后用10 mL超纯水淋洗。抽干固相萃取柱,然后用10 mL二氯甲烷洗脱,经过无水硫酸钠干燥后,在高纯氮气下将溶剂置换为正己烷后浓缩到0.3 mL。注入40 μL的0.5 mg/L的菲-d10和屈-d12内标混合液,将浓缩液定容至0.5 mL,并储存在-20 ℃下,待气相色谱-质谱分析。
1.3 仪器分析使用气相色谱质谱联用仪(GC-MS)(Trace-ISQ,Thermo)分析PAHs和HPAHs。进样口温度为280 ℃,EI离子源温度为250 ℃,传输线温度为250 ℃,脉冲不分流进样。程序升温:40 ℃保持2 min,以15 ℃/min的速度升温到150 ℃保持8 min,再以5 ℃/min升温到300 ℃保持2 min。载气为氦气,流速恒定为1 mL/min,进样量为1 μL。采用选择离子模式(SIM)进行扫描,内标法定量。
1.4 质量控制在2 L琥珀色玻璃瓶中采用超纯水进行加标回收率试验,低、中、高加标质量浓度分别设置为20,50和100 ng/L,每组设置2个平行样,35种目标化合物的回收率为60.5%~119%。实际水样中替代物2-氟联苯和对三联苯-d14的平均回收率为(88.7%±12%),(83.8%±15%)(n=78)。溶剂空白未检出目标化合物,样品空白检出Nap,Phe和Flu,将实际样品质量浓度减去空白值作为最终结果。以仪器3倍信噪比作为检测限(LOD),10倍信噪比作为定量限(LOQ)。检测限为0.06~0.50 ng/mL,定量限为0.19~1.7 ng/mL。标准曲线质量浓度为1~200 μg/L,相关系数(R2)为0.995 5~0.999 9。
1.5 健康风险评价方法用毒性当量(TEQ)来表示自来水中PAHs和HPAHs相较于BaP的毒性当量,公式如下。
| $ \mathrm{TEQ}_{\mathrm{PAHs}}=\sum c_i \times \mathrm{TEF}_{\mathrm{BaP}}^i $ | (1) |
| $ \begin{aligned} \mathrm{TEQ}_{\mathrm{HPAHs}}=\sum c_j \times \mathrm{REP}_{\mathrm{BaP}}^j \end{aligned} $ | (2) |
式中:c——水中污染物质量浓度,ng/L;i,j——单个PAH和HPAH;TEFBaP,REPBaP——单个PAH和HPAH与BaP相比的毒性等效因子[10]。
通过饮用自来水暴露的终生致癌风险(ILCR)计算公式为[10]:
| $ \mathrm{ILCR}_a=\frac{\mathrm{TEQ}_{\mathrm{PAH} / \mathrm{HPAHs}} \times \mathrm{SF} \times \mathrm{IR}_a \times \mathrm{ED}_a \times \mathrm{EF}_a}{\mathrm{BW}_a \times \mathrm{AT}_a} $ | (3) |
式中:TEQPAHs/HPAHs——PAHs或HPAHs的毒性当量,ng/L;SF——BaP的致癌斜率因子,7.3[mg/(kg·d)]-1;IR——饮水率,L/d;ED——暴露持续时间,a;EF——暴露频率,d/y;BW——体重,kg;AT——平均时间,d;a——不同年龄组。
2 结果与分析 2.1 自来水厂各工艺段出水中PAHs和HPAHs的质量浓度水平A、B、C水厂各工艺段出水中PAHs和HPAHs的质量浓度见图 1(a)—(f)。
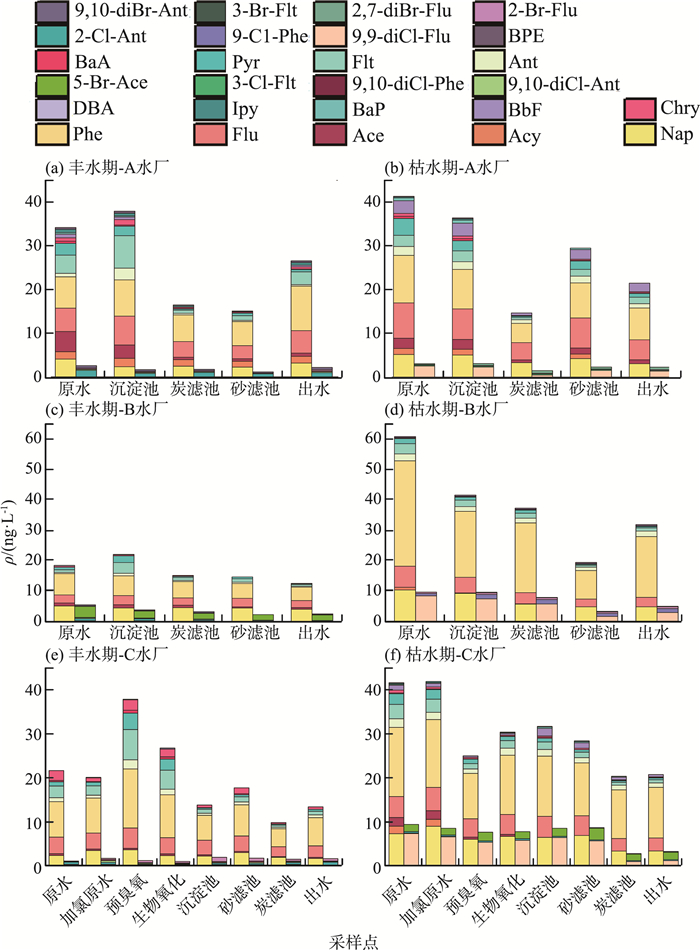
|
图 1 A、B、C水厂各工艺段水中PAHs和HPAHs的质量浓度 |
本研究选定了35种目标化合物,由图 1可见,在不同时期采样点中共检测出26种目标化合物,包括15种PAHs(Nap、Acy、Ace、Flu、Phe、Ant、Flt、Pyr、BaA、Chry、BbF、BaP、Ipy、DBA、BPE),6种Cl-PAHs (9-Cl-Phe、2-Cl-Ant、3-Cl-Flt、9,9- diCl-Flu、9,10-diCl-Ant、9,10-diCl-Phe)和5种Br- PAHs(5-Br-Ace、2-Br-flu、3-Br-Flt、2,7-diBr-Flu、9,10-diBr-Ant)。PAHs,Cl-PAHs和Br-PAHs的质量浓度分别为9.74~61.00,0.32~9.17和未检出(ND)~ 4.15 ng/L。在PAHs中,ρ(NaP)(1.54~10.34 ng/L) 和ρ(Phe)(4.12~34.82 ng/L)占ρ(PAHs)的比重较大,为6.23%~32.14%和20.91%~62.63%。PAHs中,Nap、Flu、Phe、Ant、Flt、Pyr、Chry的检出率均为100%;Cl-PAHs中,2-Cl-Ant(ND~1.51 ng/L)检出率最高,为66.67%;Br-PAHs中,2-Br-Flu(ND~0.96 ng/L)检出率最高,为83.33%。
枯水期,3个水厂的原水和出水中ρ(PAHs)和ρ(HPAHs)普遍高于丰水期(除A水厂出水PAHs含量低于丰水期外);原水和出水中平均质量浓度由高到低为:PAHs>Cl-PAHs>Br-PAHs。
2.2 原水中PAHs和HPAHs来源分析 2.2.1 PAHs来源环境介质中的PAHs来源复杂,探究其污染来源可以进行正确的风险评估,采取一定措施减少污染。利用特征比值法[22-23]来初步确定其污染来源。选取水厂原水中质量浓度相对较高的Phe、Ant、Flt、Pyr作为特征化合物,比值结果见表 1。
| 表 1 各水厂原水中PAHs的特征化合物比值 |
ρ(Ant)/[ρ(Ant)+ρ(Phe)]为0~0.1,表明污染来源是石油类污染;比值为0.1~1,表明污染来源是高温燃烧污染。ρ(Flt)/[ρ(Flt)+ρ(Pyr)]为0~0.4,表明污染来源是石油类污染;比值为0.4~0.5,表明污染来源是石油类燃烧;比值为0.5~1.0,表明污染来源是生物质和煤的燃烧。由表 1可见,A、B、C水厂原水中的多环芳烃来源并不单一,受多方面因素影响。A水厂丰水期污染主要来源于石油污染以及生物质和煤的燃烧,而枯水期的污染主要来源于各种燃烧;B水厂丰水期和枯水期污染都主要来源于石油类污染以及生物质和煤的燃烧;C水厂丰水期和枯水期污染主要来源于各种燃烧。
2.2.2 HPAHs来源汽车尾气、垃圾焚烧以及一些工业过程[4]产生的HPAHs通过沉降或者径流进入水体,进而污染水源水。对A、B、C水厂原水中PAHs和HPAHs的质量浓度做线性拟合,结果见图 2。
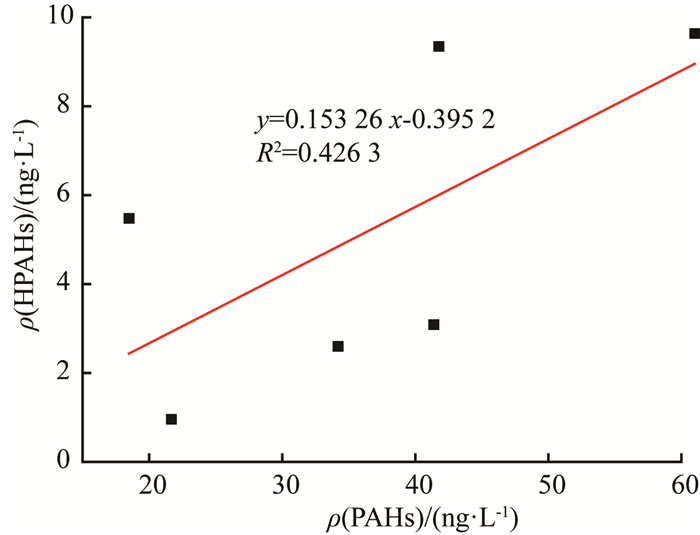
|
图 2 A、B、C水厂原水中ρ(PAHs)和ρ(HPAHs)关系 |
由图 2可见,线性方程R2为0.426 3,原水中ρ(PAHs)和ρ(HPAHs)呈正相关,说明除了上述途径,原水中的部分HPAHs来源于PAHs转化。以前的研究也表明,水中的PAHs会通过直接光转化和间接光转化生成HPAHs[6]。
A、B、C水厂丰水期和枯水期ρ(HPAHs)变化见图 3(a)—(c)。由图 3可见,ρ(HPAHs)在处理过程中总体呈现出先下降后上升的趋势,其范围为0.86~9.64 ng/L,比ρ(PAHs)低一个数量级。现有的处理工艺对原水中的HPAHs有一定的去除作用,其中炭滤池和砂滤池的去除效果最为显著。从HPAHs的种类来看,原水和出厂水之间存在一定的差异。饮用水中的HPAHs主要由2个部分组成:原水中没有被完全去除的HPAHs以及氯化消毒过程中产生的HPAHs。为了进一步提高饮用水质量,需要对这些组成部分进行深入的研究,以制定更为有效的处理策略。
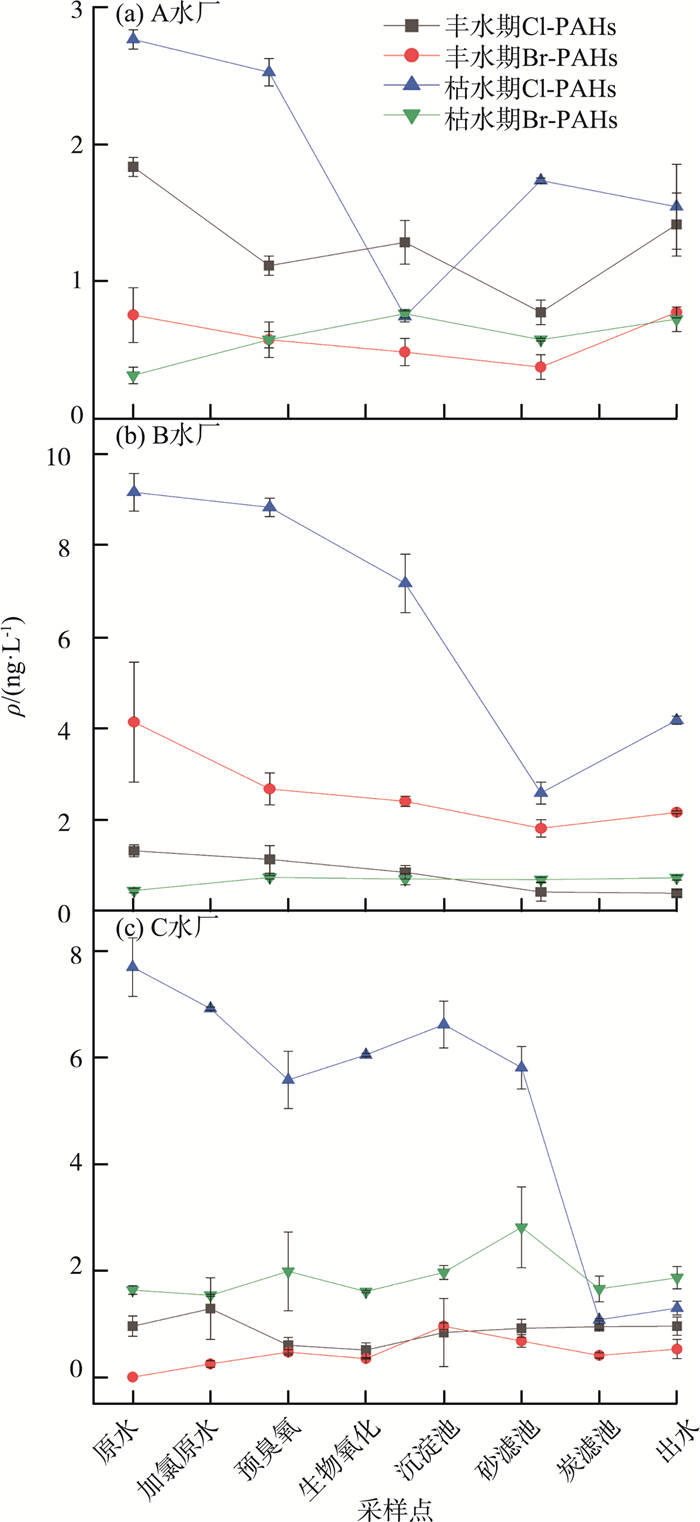
|
图 3 A、B、C水厂丰水期和枯水期ρ(HPAHs)变化 注:每个数据点上下竖线的范围代表误差范围。 |
A、B、C水厂处理工艺去除PAHs的效率分别为22.27%~48.01%,32.16%~47.51%,38.26%~50.36%,枯水期ρ(PAHs)和去除效率均高于丰水期,这与污染物的质量浓度、种类以及水厂是否对工艺段进行维护有关。A、B水厂处理工艺基本相同,而C水厂在沉淀池前补充了原水加氯、预臭氧池和生物氧化池3个工艺,对污染物的去除效率优于A、B水厂。对于水中的HPAHs,炭滤池和砂滤池去除效果最好,但是大部分采样点氯化消毒后出水浓度又有所升高,验证了之前的报道[7, 9-10],即氯化消毒会产生HPAHs。
由图 1、图 3可见,并不是每个处理工艺都对PAHs和HPAHs有正向的去除效果,一些工艺段出水的污染物质量浓度反而升高了。可能是工艺段长时间运行,吸附饱和、沉积物积累等原因,导致其对污染物的吸附和去除能力下降。在这种情况下,原本被吸附的污染物可能会重新释放到水中,导致出水污染物浓度升高。此外,值得注意的是,氯化消毒后的出水中ρ(PAHs)在多数检测结果中相对于前一工艺段出水有所上升,这一现象似乎异常。因此,在实际水厂的氯化消毒过程中,是否有新的污染源引入或者发生了某种转化,均需要进一步深入探究。
2.4 健康风险评价在检测到的HPAHs中,只能查询到9-Cl-Phe、2-Cl-Ant、9,10-diCl-Ant、9,10-diCl-Phe、3-Cl-Flt和2-Br-flu的毒性数据,因此本研究对这6种HPAHs开展致癌风险评价。按年龄将人群分为儿童(< 10岁),青少年(11~20岁)和成人(21~70岁)3组,各年龄段及所有人群经饮用A、B、C 3个水厂出水导致的健康风险计算结果见表 2。
| 表 2 3个水厂出水中PAHs和HPAHs导致各年龄段人群的健康风险 |
水厂出水的TEQPAHs为0.016~0.241 ng/L,TEQHPAHs为0.024~0.182 ng/L,总TEQ为0.042~0.330 ng/L,低于《城市供水水质标准》(CJ/T 206—2005)中的BaP限值(10 ng/L)[24]。出水中PAHs和HPAHs的终生致癌风险为10-9~10-8,< 10-6,处于美国环保署规定的低致癌风险水平[25]。不同年龄段的健康风险由大到小表现为成人>儿童>青少年,这是由暴露时间、体重和饮水率决定的。成年人的暴露时间最长,表现出最高的风险。儿童和青少年的暴露时间相同,但儿童体重小于青少年,其风险高于青少年。
A水厂丰水期出水中PAHs健康风险小于枯水期,但是HPAHs造成的健康风险比枯水期大得多,导致丰水期总体健康风险大于枯水期。B水厂丰水期出水PAHs、HPAHs的健康风险均小于枯水期。C水厂丰水期出水PAHs和总体健康风险小于枯水期,HPAHs健康风险大于枯水期。结果表明,PAHs造成的健康风险表现出季节的一致性,即枯水期大于丰水期,但是HPAHs并不一致。
值得注意的是,在A、B、C水厂丰水期出水以及C水厂枯水期出水中,虽然检测到的HPAHs质量浓度相对较低,但是其所产生的终生致癌风险却超过了PAHs。并且,枯水期和丰水期检出的种类具有差异性,一些HPAHs的毒性当量因子目前是空缺的(如9,9-diCl-Flu,5-Br-Ace等),其对应的TEQ值无法计算,无法反映真实的情况,所以最终结果中HPAHs的致癌风险低于实际值,因此饮用水中HPAHs的潜在风险仍须引起更多关注。
3 结论(1) 自来水厂各工艺段出水中普遍存在PAHs和HPAHs,共检出15种PAHs(9.74~61.00 ng/L),6种Cl-PAHs(0.32~9.17 ng/L)和5种Br-PAHs(ND~4.15 ng/L),总体呈现枯水期质量浓度大于丰水期的特征。
(2) 水厂处理工艺对PAHs和HPAHs有一定的去除作用,但是氯化消毒可能生成新的HPAHs。
(3) 饮用水中PAHs和HPAHs对人体造成的健康风险为10-9~10-8,处于低致癌风险水平。由于毒性数据以及标准物质的限制,HPAHs造成的健康风险可能远大于PAHs,应加强饮用水中HPAHs的监测。
| [1] |
吉贵祥, 顾杰, 郭敏, 等. 南京市典型地区大气多环芳烃污染特征及健康风险评价[J]. 环境监控与预警, 2021, 13(5): 87-92. |
| [2] |
于英鹏, 蒋玉波. 苏北灌河口多介质多环芳烃污染调查及生态风险分析[J]. 环境监控与预警, 2022, 14(4): 31-37. |
| [3] |
OHURA T, SAWADA K-I, AMAGAI T, et al. Discovery of novel halogenated polycyclic aromatic hydrocarbons in urban particulate matters: Occurrence, photostability and AhR activity[J]. Environmental Science & Technology, 2009, 43(7): 2269-2275. |
| [4] |
JIN R, ZHENG M, LAMMEL G, et al. Chlorinated and brominated polycyclic aromatic hydrocarbons: Sources, formation mechanisms and occurrence in the environment[J]. Progress in Energy and Combustion Science, 2020, 76: 100803. DOI:10.1016/j.pecs.2019.100803 |
| [5] |
SANKODA K, NOMIYAMA K, YONEHARA T, et al. Evidence for in situ production of chlorinated polycyclic aromatic hydrocarbons on tidal flats: Environmental monitoring and laboratory scale experiment[J]. Chemosphere, 2012, 88(5): 542-547. DOI:10.1016/j.chemosphere.2012.03.017 |
| [6] |
蔡北川, 胡学锋, 李昱洁, 等. 水环境中氯代多环芳烃的光化学生成及影响因素研究进展[J/OL]. 环境化学(2024-01-24)[2024-03-09]. https://link.cnki.net/urlid/11.1844.X.20240123.1336.006.
|
| [7] |
SANKODA K, TODA I, SEKIGUCHI K, et al. Aqueous secondary formation of brominated, chlorinated and mixed halogenated pyrene in presence of halide ions[J]. Chemosphere, 2017, 171: 399-404. DOI:10.1016/j.chemosphere.2016.12.044 |
| [8] |
HUANG C, XU X, WANG D H, et al. The aryl hydrocarbon receptor(AhR) activity and DNA-damaging effects of chlorinated polycyclic aromatic hydrocarbons(Cl-PAHs)[J]. Chemosphere, 2018, 211: 640-647. DOI:10.1016/j.chemosphere.2018.07.087 |
| [9] |
LIU Q Z, XU X, WANG L, et al. Simultaneous determination of forty-two parent and halogenated polycyclic aromatic hydrocarbons using solid-phase extraction combined with gas chromatography-mass spectrometry in drinking water[J]. Ecotoxicology and Environmental Safety, 2019, 181: 241-247. DOI:10.1016/j.ecoenv.2019.06.011 |
| [10] |
LIU Q Z, XU X, LIN L H, et al. Occurrence, health risk assessment and regional impact of parent, halogenated and oxygenated polycyclic aromatic hydrocarbons in tap water[J]. Journal of Hazardous Materials, 2021, 413: 125360. DOI:10.1016/j.jhazmat.2021.125360 |
| [11] |
CRIQUET J, RODRIGUEZ E M, ALLARD S, et al. Reaction of bromine and chlorine with phenolic compounds and natural organic matter extracts-Electrophilic aromatic substitution and oxidation[J]. Water Research, 2015, 85: 476-486. DOI:10.1016/j.watres.2015.08.051 |
| [12] |
HEEB M B, CRIQUET J, ZIMMERMANN-STEFFENS S G, et al. Oxidative treatment of bromide-containing waters: Formation of bromine and its reactions with inorganic and organic compounds-A critical review[J]. Water Research: A journal of The International Water Association, 2014, 48(1): 15-42. |
| [13] |
LIU Q Z, XU X, FU J J, et al. Role of hypobromous acid in the transformation of polycyclic aromatic hydrocarbons during chlorination[J]. Water Research, 2021, 207: 117787. DOI:10.1016/j.watres.2021.117787 |
| [14] |
LI P, WU J. Drinking water quality and public health[J]. Exposure and Health, 2019, 11(2): 73-79. DOI:10.1007/s12403-019-00299-8 |
| [15] |
NGUYEN-DUY D, CHANG M B. Review on characteristics of PAHs in atmosphere, anthropogenic sources and control technologies[J]. Science of The Total Environment, 2017, 609: 682-693. DOI:10.1016/j.scitotenv.2017.07.204 |
| [16] |
AKHBARIZADEH R, DOBARADARAN S, TORKMAHALLEH M A, et al. Suspended fine particulate matter(PM2.5), microplastics(MPs) and polycyclic aromatic hydrocarbons(PAHs) in air: Their possible relationships and health implications[J]. Environmental Research, 2021, 192: 110339. |
| [17] |
DAI C M, HAN Y M, DUAN Y P, et al. Review on the contamination and remediation of polycyclic aromatic hydrocarbons(PAHs) in coastal soil and sediments[J]. Environmental Research, 2022, 205: 112423. |
| [18] |
BACOSA H P, INOUE C. Polycyclic aromatic hydrocarbons(PAHs) biodegradation potential and diversity of microbial consortia enriched from tsunami sediments in Miyagi, Japan[J]. Journal of Hazardous Materials, 2015, 283: 689-697. |
| [19] |
KUMAR M, BOLAN N S, HOANG S A, et al. Remediation of soils and sediments polluted with polycyclic aromatic hydrocarbons: To immobilize, mobilize, or degrade?[J]. Journal of Hazardous Materials, 2021, 420: 126534. |
| [20] |
KUPPUSAMY S, THAVAMANI P, VENKATESWARLU K, et al. Remediation approaches for polycyclic aromatic hydrocarbons(PAHs) contaminated soils: Technological constraints, emerging trends and future directions[J]. Chemosphere, 2017, 168: 944-968. |
| [21] |
MENG Y, LIU X H, LU S Y, et al. A review on occurrence and risk of polycyclic aromatic hydrocarbons(PAHs) in lakes of China[J]. Science of The Total Environment, 2019, 651: 2497-2506. |
| [22] |
黄亚龙. 巢湖PAHs在水—沉积物的垂直浓度分布及交换过程研究[D]. 合肥: 合肥工业大学, 2019.
|
| [23] |
DE PERRE C, LE MENACH K, IBALOT F, et al. Development of solid-phase microextraction to study dissolved organic matter-polycyclic aromatic hydrocarbon interactions in aquatic environment[J]. Analytica Chimica Acta, 2014, 807: 51-60. |
| [24] |
中华人民共和国建设部. 城市供水水质标准: CJ/T 206—2005[S]. 北京: 当代世界出版社, 2005.
|
| [25] |
WANG X, KANG H, WU J. Determination of chlorinated polycyclic aromatic hydrocarbons in water by solid-phase extraction coupled with gas chromatography and mass spectrometry[J]. Journal of Separation Science, 2016, 39(9): 1742-1748. |
 2024, Vol. 16
2024, Vol. 16 

