小泡巨鼠[(Leopoldamys edwardsi)(Thomas,1882)]隶属于鼠科(Muridae)小泡巨鼠属(Leopoldamys),指名亚种(L.e.edwardsi)模式产地为福建省西部[1-3]。我国已记录的本属物种共有2种,分别是小泡巨鼠与耐氏大鼠(L. neilli)[4-5]。2019年在江苏宜兴采集到大型鼠科标本1号,根据外形与头骨特征,并结合分子系统发生分析,确认该标本为小泡巨鼠,为江苏省兽类属、种新纪录。
江苏原记录白腹鼠属(Niviventer)物种包括北社鼠[(N.confucianus)(Milne-Edwards,1871)]和海南社鼠[(N.lotipes)(Allen,1926)]2种[3, 6-8],均隶属于喜马拉雅社鼠复合种(N.niviventer species complex,NNSC)[6]。其中,北社鼠在国内有13个亚种,指名亚种(N.c.confucianus)模式产地为四川宝兴;海南社鼠无亚种划分,模式产地为海南那大[6]。上述2个白腹鼠属物种在部分产地同域分布,且形态特征高度相似,野外难以区分[8];江苏省尚缺乏本属标本的头骨测量数据,且缺少遗传谱系的对比研究。2022—2023年,在江苏南京采集到的12号白腹鼠属标本经形态学、分子系统学和地理分析,确认均为海南社鼠,为江苏产海南社鼠的形态学特征、遗传多样性和地理分布格局提供了重要补充。
1 研究材料与方法 1.1 标本采集与保存2019年3月16日,在江苏省宜兴市太华镇(119.563 922 73 ° E,31.186 581 79 ° N),通过铗日法采集到1号雄性小泡巨鼠属标本(标本号:NAUL190301)。2022年10、11月及2023年4月,在江苏省南京市江宁区汤山(118.995 810 21 ° E,31.992 147 46 ° N)与高淳区马鞍山(118.956 078 1 ° E,31.271 916 7 ° N)采集到白腹鼠属标本共计12号(雌、雄各6号;标本号:NAUN221001,NAUN221101—NAUN221105,NAUN230401—NAUN230406)。经外形拍照、头骨制备和肝脏组织取样后,形态标本用福尔马林溶液固定,头骨标本保存于干燥盒内,组织样本浸于95%乙醇中,置于-20 ℃保存。上述标本均保存于南京农业大学生命科学学院生物标本馆。
1.2 形态特征测量参考杨奇森等[9]、夏霖等[10]及唐明坤等[11]的方法,使用数显游标卡尺(精度为0.01 mm)测量标本外形和头骨数据。小泡巨鼠属标本外形测量指标包括:头体长(head body length,HBL)、尾长(tail length,TL)、后足长(hind foot length,HFL)和耳高(ear length,EL);白腹鼠属标本外形测量指标包括HBL和TL。头骨测量指标包括:颅全长(profile length,PL)、颅基底长(skull basilar length,SBL)、基长(basal length,BL)、吻宽(greatest breadth of snout,GBS)、颧宽(zygomatic breadth,ZB)、眶间距(least breadth between the orbits,LBO)、颅宽(occipital breadth,OB)、脑颅高(height of braincase,HB)、腭长(median palatal length,MPL)、听泡长(length of the tympanic bulla,LTB)、上颌齿隙长(length of the diastema,LD)、上齿列长(length of upper tooth row,LUTR)、下颌长(length of mandible,LM)和下齿列长(length of lower tooth row,LLTR)。
1.3 DNA提取与目的片段扩增取肝脏组织约20 mg,使用DNA提取试剂盒(cell/Tissue DNA Isolation Mini Kit-BOX1,南京诺唯赞生物科技股份有限公司)提取总DNA。细胞色素b(Cytochrome b,Cyt b)基因序列采用自行设计的引物Rat001F:5′-ATGACAAACATCCGAAAAAC-3′和Rat002R:5′-GTTTCATTTTAG CATTTTGT-3′进行聚合酶链式反应(PCR)扩增;细胞色素氧化酶Ⅰ(Cytochrome Oxidase Ⅰ,COI)序列采用通用引物BatL5310:5′-CCTACTCRG CCATTTTACCTATG-3′和R6036R:5′-ATCTCT GGGTGTCCAAAGAATCA-3′进行扩增[12];16S核糖体核糖核酸(16S ribosomal RNA,16S rRNA)序列采用通用引物16SA:5′-CGCCTGTTTAA CAAAAACAT-3′和Hm:5′-AGATCACGTAGGACTTTAAT-3′进行扩增[13]。PCR反应程序为:94 ℃ 5 min;94 ℃ 30 s,48 ℃ 60 s,72 ℃ 80 s,35个循环;72 ℃ 10 min。PCR产物进行桑格法双向测序。
1.4 系统发生分析使用综合性序列分析软件Lasergene[14]中的SeqMan子程序对上述序列进行校准拼接。将组装好的序列上传至美国国家生物技术信息中心建立的DNA序列数据库(GenBank)(https://www.ncbi.nlm.nih.gov/)。小泡巨鼠属样本的细胞色素b(Cyt b),细胞色素氧化酶Ⅰ(COI)和16S核糖体核糖核酸(16S rRNA)的序列登录号分别为PP475778,PP658526和PP665596;白腹鼠属样本的(Cyt b)序列登录号为OR619531—OR619542。
从GenBank下载小泡巨鼠属、白腹鼠属及家鼠属(Rattus)的细胞色素b(Cyt b)序列22条,细胞色素氧化酶Ⅰ (COI)序列22条以及16S核糖体核糖核酸(16S rRNA)序列17条,包括:小泡巨鼠(n=6,n为参与统计的样本数量,下同)、耐氏大鼠(n=2)、喜马拉雅社鼠(n=2)、北社鼠(n=2)、安氏白腹鼠(N.andersoni)(n=2)、黑家鼠(R.rattus)(n=2)、缅鼠(R.exulans)(n=2)、黄胸鼠(R.tanezumi)(n=2) 和褐家鼠(R.norvegicus)(n=2),共计9种。选取巢鼠(Micromys minutus)(n=1)和小鼠(Mus musculus)(n=1)作为外群。用多序列比对软件MEGA 11[15]中的ClustalW程序分别对3个基因片段进行同源比对,两端裁齐后按顺序串联拼接。
从GenBank下载白腹鼠属的细胞色素b(Cyt b)序列101条,包括:海南社鼠(n=29)、北社鼠(n=40)、喜马拉雅社鼠(n=2)、安氏白腹鼠(n=2)、川西白腹鼠(N.excelsior)(n=2)、针毛鼠(N.fulvescens)(n=2)、灰腹鼠(N.eha)(n=2)、褐尾鼠(N.cremoriventer)(n=2)、梵鼠(N.brahma)(n=2)、台湾社鼠(N.culturatus)(n=2)、短尾社鼠(N.bukit)(n=2)、台湾白腹鼠(N.coninga)(n=2)、冯氏白腹鼠(N.fengi)(n=2)、剑纹小社鼠(N.gladiusmaculus)(n=2)、华南针毛鼠(N.huang)(n=2)、湄公针毛鼠(N.mekongis)(n=2)、片马社鼠(N.pianmaensis)(n=2)和山东社鼠(N.sacer)(n=2),共计18种;选取褐家鼠(n=1)和小鼠(n=1)作为外群。
使用MEGA 11中p-distance模型计算研究样本与内群物种间的遗传距离。采用核苷酸替换模型软件MrModeltest2[16]计算最适碱基替代模型。采用系统树构建软件MrBayes3.2.7[17]进行贝叶斯推断(Bayesian inference,BI),并计算贝叶斯系统发生树每个节点的后验概率(posterior pro-bability,PP);蒙特卡罗马尔科夫链(Markov Chain Monte Carlo,MCMC)运行代数为5 000 000次,计算一致树(consensus tree)之前舍弃前25%的迭代结果。用数据可视化工具ChiPlot程序[18]对系统发生树进行可视化和注释。
1.5 地理分布格局分析采用已报道的喜马拉雅社鼠复合种(NNSC)系统发生的研究文献,获取经过分子系统学验证的北社鼠和海南社鼠样本的采集地经纬度[6-8],并结合本研究样本,使用开源的地理信息系统软件QGIS3.36.1[19]对其中采集自江苏、安徽、浙江和江西4省的样本进行位点标注。数字高程采用中国科学院计算机网络信息中心地理空间数据云平台(https://www.gscloud.cn/)中90 m分辨率的航天雷达地形测绘项目数字高程模型数据集(Shuttle Radar Topography Mission Digital Elevation Model at 90-Meter Resolution,SRTMDEM 90M)[20];省界、水系等基础地理数据采用审图号为GS(2016)2927的中国地图。
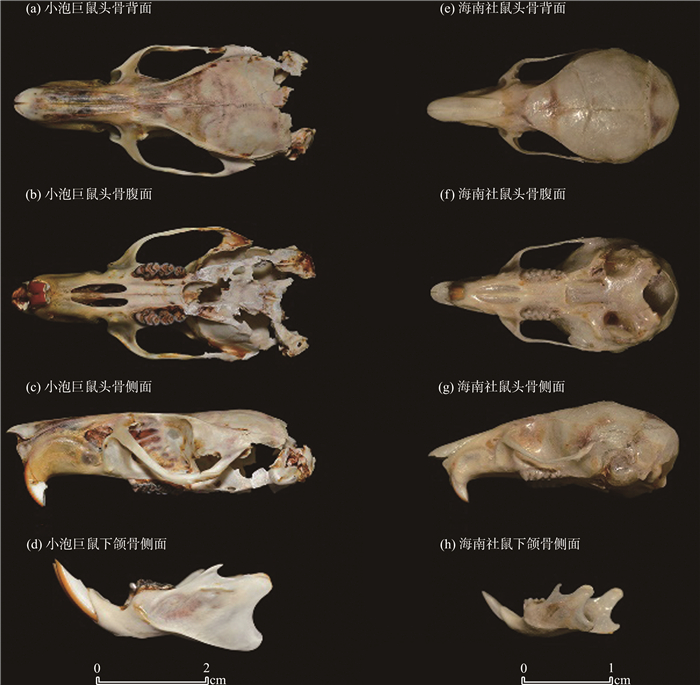
2 研究结果 2.1 小泡巨鼠属标本形态特征小泡巨鼠属标本背毛为深棕色,背中央杂有较多黑毛,混有针状硬毛;腹毛白色,短而柔滑;背腹毛色具明显界限;尾背部深棕色,腹面尾毛白色;前、后足背面棕褐色,两侧与趾端白色[图 1(a)—(c)]。

|
图 1 江苏宜兴产小泡巨鼠标本(南京农业大学动物标本馆,标本号:NAUL190301) |
该雄性标本体躯甚大,头体长(HBL)=243.36 mm;尾粗壮,尾长(TL)=309.11 mm,显著超过体长;耳大而薄,耳高(EL)=35.70 mm,向前翻折能遮住眼睛;后足长(HFL)=52.14 mm(图 1、表 1);胸部和鼠蹊部各具2对乳头;生殖器距离肛门较远。
| 表 1 江苏宜兴产小泡巨鼠和不同产地指名亚种头骨形态比较① |
头骨粗大而窄长,颅骨宽平,颅全长(PL)=60.61 mm;听泡退化,小而扁平,听泡长(LTB)=10.81 mm,仅为颅全长的17.8%;眶上脊发达[图 2(a)]。上颌第1臼齿第1横脊的外齿突退化,内齿突向后延伸;第3横脊内齿突亦退化[图 2(b)]。鼻骨前段显著超出上门齿[图 2(c)]。采集时标本头骨后部碎裂,无法修复。上述形态特征与小泡巨鼠的原始描述一致,大部分形态测量值均在华东产地标本的数据范围内[1-2, 21-24]。由于上颌骨枕部破损,听泡与基枕骨的衔接位置难以确定,听泡长(LTB)的数据测量可能存在误差。
|
图 2 江苏产小泡巨鼠(标本号:NAUL190301)和海南社鼠(标本号:NAUN221102)头骨 |
白腹鼠属标本平均全长236.88 mm,背腹毛色分界明显,背部为深黄棕色,夹杂棕白色粗硬针刺毛,侧面黄棕色色调明显,腹部呈淡黄白色。前后足远端及趾白色,腕掌部后端中央和跗跖部中央大部分为深棕色,两侧白色。尾上部至尾尖均为棕色,下部前半段棕色、后半段渐变为淡黄白色。头盖骨成椭圆形,听泡小而圆,切牙孔形状尖锐,两侧略成弧形且后缘不延伸至上颌齿[图 2(e)—(h)]。其中,NAUN230401样本枕部存在明显缺损,导致部分头骨测量数据缺失(表 2)。上述形态特征与经过分子系统学验证的海南社鼠的原始描述一致,形态测量值均在海南社鼠标本的数据范围内[6]。
| 表 2 江苏南京产海南社鼠标本形态及头骨测量值① |
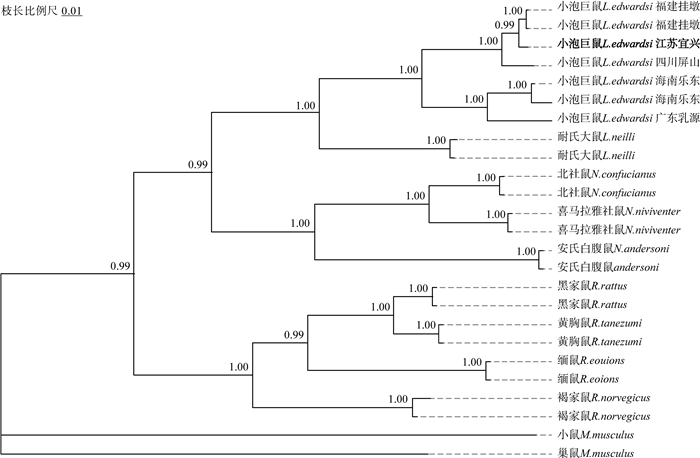
小泡巨鼠属样本与白腹鼠属物种(n=6)的细胞色素b+细胞色素氧化酶Ⅰ +16S核糖体核糖核酸(Cyt b + COI + 16S rRNA)联合数据集的遗传距离为13.9%~14.7%(平均值为14.4%),与家鼠属物种(n=8)的遗传距离为14.8%~15.7%(平均值为15.3%);最大值和最小值分别出现在缅鼠(15.7%)和北社鼠(13.9%)之间。与同属的耐氏大鼠(n=2)遗传距离均为10.2%;与小泡巨鼠(n=6)的种内遗传距离为0.7%~8.2%(平均值为4.7%),最大值和最小值分别出现在与广东乳源和福建挂墩的样本之间。
细胞色素b(Cyt b)、细胞色素氧化酶Ⅰ(COI)与16S核糖体核糖核酸(16S rRNA)基因片段同源比对拼接后获得总长为2207碱基对(base pair,bp)的数据集,最适碱基替代模型为广义时间可逆模型+不变位点+伽马分布(General time-reversible model with invariant sites and gamma distribution,GTR+I+G)。基于上述基因片段的系统发生分析表明:本研究样本嵌合在其他小泡巨鼠样本分支(n=6)内部,形成一个高支持率的分支[后验慨率(posterior probability,PP)=1.00];该样本先与福建挂墩样本(n=2)聚成一支(PP=0.99),再与四川屏山样本(n=1)聚成一支(PP=1.00),上述分支再与海南乐东(n=2)+广东乳源(n=1)的分支相聚(PP=1.00)(图 3)。上述遗传距离和分子系统学结果进一步支持该样本为小泡巨鼠。
|
图 3 基于Cyt b、COI和16S rRNA基因构建的小泡巨鼠及部分鼠科物种的贝叶斯树 注:粗体代表本研究样本。 |
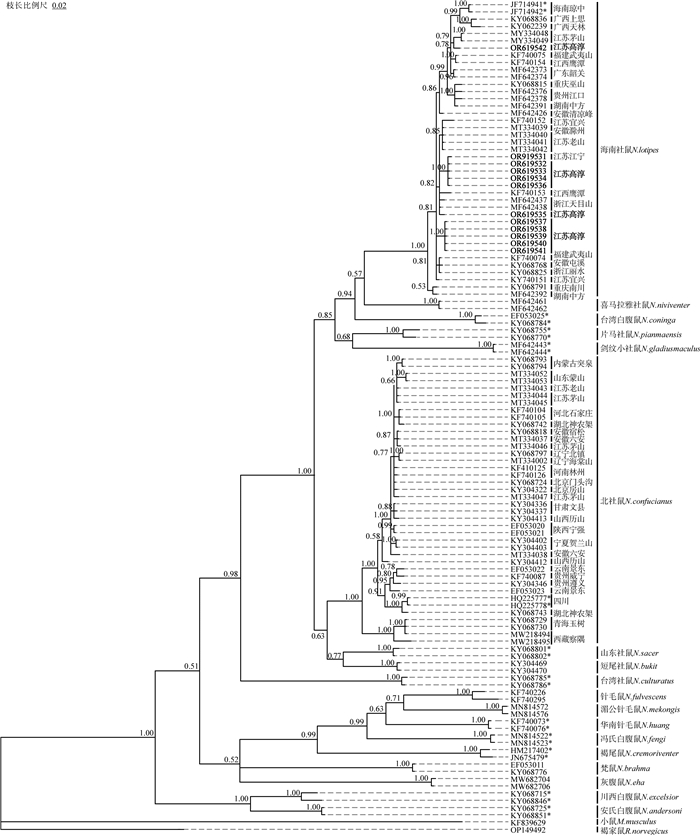
12个白腹鼠属样本与属内其他物种(n=72)的细胞色素b(Cyt b)遗传距离为6.5%~14.2%(平均值为9.0%),最大值和最小值分别出现在与针毛鼠(n=2)和北社鼠(n=40)之间;与海南社鼠(n=29)的种内遗传距离为0.2%~2.3%(平均值为1.1%)。
同源比对后获得长度为924 bp的数据集,最适碱基替代模型为GTR+I+G。基于细胞色素b(Cyt b)基因序列构建的系统发生树显示:本研究白腹鼠属样本分别形成4个独立分支嵌合在其他海南社鼠样本中,形成了高支持率的海南社鼠分支(PP=100%)(图 4)。遗传距离和分子系统学结果均支持本研究中江苏南京白腹鼠属样本为海南社鼠。
|
图 4 基于Cyt b基因构建的白腹鼠属部分物种的贝叶斯树 注:*代表模式产地标本;粗体代表本研究样本。 |
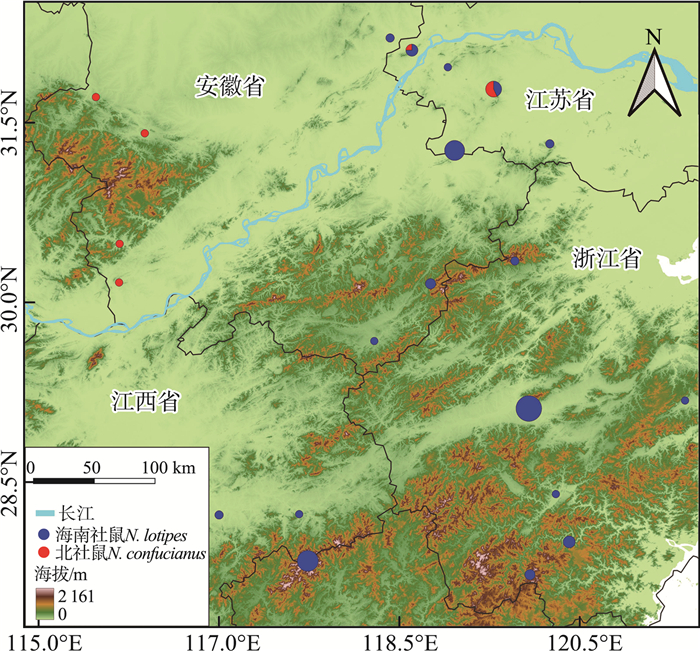
根据采集地信息绘制的地理分布图显示,在江苏、浙江、安徽、江西4省范围内经过分子系统学验证的海南社鼠分布于:江苏省老山山脉、宁镇山脉(汤山)、高淳南部、茅山山脉和宜溧山地等,浙江省临安天目山、金华、天台、丽水、景宁、泰顺等,安徽省南部山区(屯溪、清凉峰)以及滁州的江淮丘陵地带,以及江西省武夷山脉。北社鼠在上述4省内主要分布于安徽省西部的大别山区以及江苏省的老山山脉和茅山山脉。二者有2个明确的同域分布区,均在江苏省内,分别是南京老山和句容茅山(图 5)。上述信息显示海南社鼠和北社鼠基本以长江为界形成南/北分布格局,海南社鼠为较典型的东洋种,而北社鼠为较典型的古北种。
|
图 5 海南社鼠与北社鼠在江苏及邻域长江下游地区的分布格局 注:饼图大小代表样本数量。 |
系统发生分析显示,本研究小泡巨鼠样本与福建挂墩的样本聚为高支持率的一支(PP=100%),且遗传距离仅为0.7%;而与其他产地样本均有较大遗传距离,分别为2.5%(四川屏山),8.8%(海南乐东)和9.0%(广东乳源)。综合遗传距离和系统发生分析,并考虑地理分布,推断本研究中小泡巨鼠标本隶属于指名亚种,该亚种分布于贵州、湖南、安徽、江西、浙江、福建、广东和广西[3]。此外,有分子系统学研究表明小泡巨鼠为复合种,其种下的海南分支(对应形态学划分的海南亚种L.e.hainanensis)和江西、广东、广西、越南的分支应为2个隐存种[25],这与本研究的遗传距离结果较为一致。江苏宜兴为目前华东地区小泡巨鼠的分布北界。
白腹鼠属的分类地位在1981年被提出[26],随后的分子系统学研究发现其中有大量并系物种和隐存种存在,并被划分为多个复合种[6, 27-28]。广义北社鼠(N.confucianus sensu lato)是东洋界常见的小型啮齿类动物,系白腹鼠属中分布最广泛的类群之一,早期文献认为其分布于我国除宁夏、新疆、辽宁和黑龙江以外的绝大部分省区以及泰国北部和越南北部[28]。近年来,广义北社鼠被拆分为多个独立物种,导致狭义北社鼠(N.confucianus sensu stricto)的实际分布范围被高估[6-7, 29]。海南社鼠则长期被认为是北社鼠的海南亚种(N.c. lotipes)[28],直到2008年才作为独立种被描述[30]。海南社鼠最早被认为仅分布于海南岛,而后基于大规模采样的分子系统学研究扩展了其地理分布范围,确认其在中国长江以南地区广泛分布[6]。但仍缺少对海南社鼠、北社鼠的小尺度空间分布格局,尤其是同域分布(sympatry)的研究。
地理分析显示长江下游干流对海南社鼠和北社鼠的分布格局产生了较显著的隔离作用;但同时,在长江沿岸的南京老山和句容茅山也有二者同域分布的情况(图 5)。这可能是由于长江下游河段一直频繁改道,尤其是芜湖至南京江段处于丘陵山地与平原的交接地带,河道存在大量分汊,不断有江心沙洲出现和并岸;此外,三峡工程也对长江下游水系产生了深远复杂的影响[31-35]。在此过程中,上述两物种可能有部分种群完成小尺度的跨江扩散,并最终和对岸原有的物种形成新的群落结构,并可能在二次接触区内存在种间杂交和基因渐渗。未来应综合谱系地理学和种群遗传学方法对上述问题进行深入研究。
致谢: 南京农业大学胡金良和安徽大学虞磊为本文标本采集提供了帮助。
| [1] |
董聿茂. 浙江动物志: 兽类[M]. 浙江: 浙江科学技术出版社, 1989: 88-89.
|
| [2] |
王岐山. 安徽兽类志[M]. 浙江: 浙江科学技术出版社, 1990: 181.
|
| [3] |
魏辅文. 中国兽类分类与分布[M]. 北京: 科学出版社, 2022.
|
| [4] |
陈鹏, 王应祥, 林苏, 等. 中国兽类新纪录——耐氏大鼠Leopoldamys neilli[J]. 四川动物, 2014, 33(6): 858-864. |
| [5] |
魏辅文, 杨奇森, 吴毅, 等. 中国兽类名录(2021版)[J]. 兽类学报, 2021, 41(5): 487-501. |
| [6] |
GE D Y, LU L, XIA L, et al. Molecular phylogeny, morphological diversity, and systematic revision of a species complex of common wild rat species in China(Rodentia, Murinae)[J]. Journal of Mammalogy, 2018, 99(6): 1350-1374. DOI:10.1093/jmammal/gyy117 |
| [7] |
王思虎. 社鼠亲缘地理关系与适应性进化[D]. 济南: 山东大学, 2017.
|
| [8] |
LI Y Y, LI Y Q, LI H T, et al. Niviventer confucianus sacer(Rodentia, Muridae) is a distinct species based on molecular, karyotyping, and morphological evidence[J]. Zookeys, 2020, 959: 137-159. DOI:10.3897/zookeys.959.53426 |
| [9] |
杨奇森, 夏霖, 马勇, 等. 兽类头骨测量标准Ⅰ: 基本量度[J]. 动物学杂志, 2005(3): 50-56. |
| [10] |
夏霖, 杨奇森, 马勇, 等. 兽类头骨测量标准Ⅲ: 啮齿目、兔形目[J]. 动物学杂志, 2006(5): 68-71. |
| [11] |
唐明坤, 索郎夺尔基, 王旭明, 等. 四川白腹鼠属(啮齿目: 鼠科)一新分布记录及其形态学研究[J]. 四川动物, 2023, 42(1): 61-74. |
| [12] |
郭丽民, 席进孝, 师占文, 等. DNA条形码对平川区阿拉善黄鼠疫源地鼠种鉴定的效果评价[J]. 疾病预防控制通报, 2019, 34(6): 1-3, 24. |
| [13] |
NICOLAS V, SCHAEFFER B, MISSOUP A D, et al. Assessment of three mitochondrial genes(16S, Cytb, COI) for identifying species in the Praomyini Tribe(Rodentia: Muridae)[J]. PLoS One, 2012, 7(5): e36586. DOI:10.1371/journal.pone.0036586 |
| [14] |
BURLAND T G. DNASTAR's Lasergene sequence analysis software[J]. Methods in Molecular Biology, 2000, 132: 71-91. |
| [15] |
TAMURA K, STECHER G, KUMAR S. MEGA11: Molecular evolutionary genetics analysis version 11[J]. Molecular Biology and Evolution, 2021, 38(7): 3022-3027. |
| [16] |
NYLANDER J A A. MrModeltest v2[CP/OL]. (2008-05-22)[2024-05-25]. https://github.com/nylander/MrModeltest2.
|
| [17] |
HUELSENBECK J P, RONQUIST F. MRBAYES: Bayesian inference of phylogenetic trees[J]. Bioinformatics, 2001, 17(8): 754-755. |
| [18] |
XIE J, CHEN Y R, CAI G J, et al. Tree visualization by one table(tvBOT): A web application for visualizing, modifying and annotating phylogenetic trees[J]. Nucleic Acids Research, 2023, 51: W587-W592. |
| [19] |
QGIS Association. QGIS geographic information system[CP/OL]. (2024-3-26)[2024-5-25]. http://www.qgis.org.
|
| [20] |
中国科学院计算机网络信息中心地理空间数据云平台. SRTMDEM 90M分辨率原始高程数据[DB/OL]. [2024-5-25]. http://www.gscloud.cn.
|
| [21] |
寿振黄. 中国经济动物志: 兽类[M]. 北京: 科学出版社, 1962: 264.
|
| [22] |
盛和林. 中国哺乳动物图鉴[M]. 郑州: 河南科学技术出版社, 2005.
|
| [23] |
SMITH A T, 解焱. 中国兽类野外手册[M]. 长沙: 湖南教育出版社, 2009.
|
| [24] |
徐龙辉, 余斯绵. 小泡巨鼠(Edwards' rat)一新亚种——海南小泡巨鼠[J]. 兽类学报, 1985(2): 131-135. |
| [25] |
LI H, KONG L, WANG K, et al. Molecular phylogeographic analyses and species delimitations reveal that Leopoldamys edwardsi(Rodentia: Muridae) is a species complex[J]. Integrative Zoology, 2019, 14(5): 494-505. |
| [26] |
MUSSER G G. Results of the archbold expeditions. No. 105. notes on systematics of Indo-Malayan murid rodents, and descriptions of a new genera and species from Ceylon, Sula-wesi, and the Philippines[J]. Bulletin of the American Museum of Natural History, 1981, 168(3): 229-334. |
| [27] |
鲍毅新. 社鼠的研究概要[J]. 浙江师范大学学报(自然科学版), 1993(2): 50-54. |
| [28] |
彭培英, 郭宪国. 社鼠的研究现状及进展[J]. 四川动物, 2014, 33(5): 792-800. |
| [29] |
GE D Y, LU L, ABRAMOV A V, et al. Coalescence models reveal the rise of the white-bellied rat(Niviventer confucianus) following the loss of Asian megafauna[J]. Journal of Mammalian Evolution, 2019, 26(3): 423-434. |
| [30] |
LI Y C, WU Y, HARADA M, et al. Karyotypes of three rat species(Mammalia: Rodentia: Muridae) from Hainan Island, China, and the valid specific status of Niviventer lotipes[J]. Zoological Science, 2008, 25: 686-692. |
| [31] |
王茂枚, 姜果, 朱昊, 等. 长江老海坝段近期河道演变及其影响因素分析[J]. 水运工程, 2023(1): 88-96. |
| [32] |
李雪峰. 安徽省长江水沙及河势变化分析[J]. 吉林水利, 2020(5): 41-44. |
| [33] |
谷霄鹏. 长江芜湖河段大拐崩岸段河道演变分析[J]. 水利规划与设计, 2019(11): 4-8. |
| [34] |
渠庚, 丁兵, 柴朝晖, 等. 长江下游河道发育过程与综合治理研究[M]. 北京: 中国水利水电出版社, 2021.
|
| [35] |
刘星童, 渠庚, 徐一民. 长江马鞍山河段演变规律与治理思路研究[J]. 人民长江, 2021, 52(6): 1-6. |
 2024, Vol. 16
2024, Vol. 16 

