湖泊作为水生态系统的重要组成部分以及地表水资源的主要载体,具有重要的文化、经济与生态价值[1-2],更是生物多样性最丰富、最集中的地区之一[3]。鱼类是湖泊生态系统最为重要的生物因子之一[4],一方面鱼类作为渔业资源蕴含了巨大的经济价值,另一方面鱼类作为水生态系统中的顶级消费者,能够对水质以及水生态健康作出灵敏响应,较好反映水生态环境状况[5-6]。近年来,经济的快速发展以及日趋频繁的人类活动使得部分湖泊水质恶化、水域面积减少,加上过度捕捞、外来物种入侵等多种因素威胁[7-8],直接造成湖泊鱼类生物多样性水平和鱼类种群占比持续下降[9]。
生物多样性是人类生存与发展的基础,鱼类多样性也是水生态系统维持稳定的重要因素,开展鱼类监测是保护鱼类多样性的重要举措[10]。当前鱼类监测方法主要包括样本调查法、声学法以及环境DNA(eDNA)法等。样本法和声学法是基于传统的地面调查方法进行研究,且多集中于物种个体和样地水平尺度,因此存在一定的局限性。样本法的主要局限性在于数据处理难度大、误差大和数据不连续等,而声学特征的不确定性,如物种遗传、行为和环境导致的鸣声复杂性,增加了物种识别和分类的难度,难以满足长期持续的监测调查[11],而eDNA技术一定程度上弥补了这些不足,为鱼类监测提供了新的思路。eDNA技术利用收集鱼类在水中掉落的皮肤细胞、代谢废物等残留物质,提取其中的DNA后通过引物扩增、高通量测序和生物信息学分析等操作,实现对鱼类物种序列定性或定量地分析[12]。目前,eDNA技术已初步应用于河湖鱼类多样性调查和研究领域中[12-15],且相比于其他方法,鱼类物种检出效率较高[13]。
白马湖位于江苏省淮安市东南侧、洪泽湖下游,是江苏省十大湖泊之一,也是全国15个生态良好的重点湖泊之一,是淮河入江水系的重要生态节点。作为淮河流域原生态、纯天然的平原浅水型淡水湖泊,白马湖承担区域供水、旅游以及生态保护多项功能。目前,白马湖公开资料显示多年连续监测到鱼类共69种,为全面了解白马湖鱼类多样性现状,本研究基于eDNA技术对白马湖鱼类现状及其多样性进行调查分析,并综合现有相关管理部门对鱼类的统计调查数据进行对比分析,以期为白马湖区域科学管理鱼类资源、湖泊生态状况评估提供数据支撑。
1 研究方法 1.1 样品采集与处理以白马湖湖区作为研究区域,参考原有鱼类资源调查点位以及湖泊自然地理特征,在全湖共设置10个采样点位(图 1)。于2023年4—5月开展鱼类eDNA样品采集工作。每个采样点共采集3个平行样品,每个平行样品采集5 L水样。样品现场采集完成后放入4 ℃冷藏箱低温避光运输至实验室后,于24 h内利用真空抽滤装置将水样过滤至0.45 μm孔径的混合纤维素酯滤膜上,抽滤完成后将滤膜置于离心管中并于-20 ℃保存。
|
图 1 监测点位分布示意(S1—S10) |
使用DNeasy血液及组织核酸提取试剂盒,(德国Qiagen公司),对白马湖采集样品进行eDNA提取。利用鱼类12S rRNA通用引物Tele02(Tele02-F:5′-AAACTCGTGCCAGCCACC-3′、Tele02-R:5′GGGTATCTAATCCCAGTTTG-3′)对进行聚合酶链式反应(PCR)扩增,PCR反应体系采用25 μL的总体系,包括:12.5 μL TaKaRa酶[TB Green Ⓡ Premix Ex TaqTM Ⅱ,宝日医生物技术(北京)有限公司],0.5 μL荧光校正染料(Dye),0.5 μL牛血清血红蛋白(BSA),8.7 μL超纯水,0.5 μL正向引物,0.5 μL反向引物和1.8 μL模板DNA。PCR反应程序主要为:预变性95 ℃持续30 s,变性95 ℃持续30 s,退火56.3 ℃持续30 s,延伸72 ℃持续20 s,持续31次循环,终末延伸72 ℃ 10 min,保存在4 ℃条件下。每1次PCR反应均设置至少2个阴性对照和2个阳性对照,阴性对照使用超纯水作为模板,用于监测PCR反应过程中的污染情况;阳性对照使用调查区域没有分布的鱼类组织材料DNA作为模板,本研究中选择作为阳性对照的鱼类是斜带石斑鱼(Epinephelus coioides)和青石斑鱼(Epinephelus awoara),这2个种为典型的海洋鱼类,在白马湖没有分布。每个eDNA样品重复扩增获得4个阳性产物。使用1.5%的琼脂糖凝胶电泳检测PCR扩增结果,将PCR阳性产物保存于-20 ℃,用于后续实验。PCR产物用MinElute PCR纯化试剂盒(德国Qiagen公司)纯化样品。采用因美纳测序平台进行PE150双端测序,获得所有样品原始序列后,切除序列引物片段,并过滤长度较小无效序列,去除重复序列和嵌合体后按相似水平>97%进行分类操作单元(Operational taxonomic unit,OTU)聚类分析,以网络公开数据库为数据来源检索注释鱼类物种数据并输出OTU表格。
1.3 统计分析选取香农-维纳(Shannon-Wiener)多样性指数(H′)、Margalef丰富度指数(D)和Pielou均匀度指数(J)对白马湖不同样点的生物多样性程度进行分析评价,使用R语言vegan包与picante包中的Alpha_diversity函数进行多样性指数的计算。同时为了对白马湖鱼类结构特征进行分析,基于各采样点鱼类OTU数目完成层次聚类分析(Cluster)、非度量多度分析(NMDS)以及相似性分析(Analysis of similarities,ANOSIM),并构建聚类分析图与NMDS图,探索不同位置鱼类群落组成的差异性或相似性。群落结构相似性分析使用Primer 6.0软件进行分析与可视化输出。
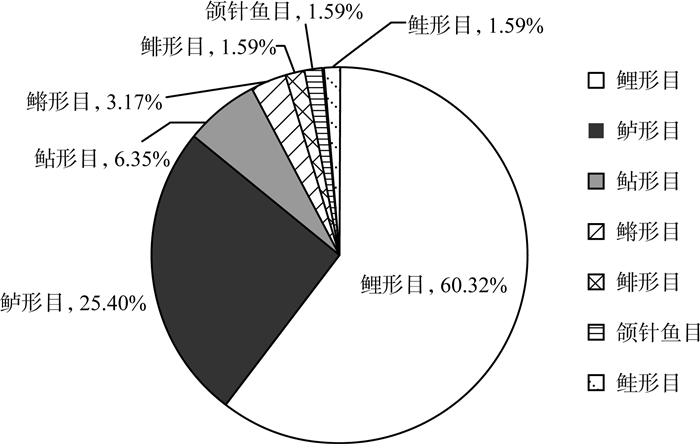
2 结果与分析 2.1 白马湖鱼类物种组成各采样点位样品中经高通量测序后的原始序列共7 014 467条,经拼接筛选注释后共获得鱼类物种序列有1 262 604条,共检测到鱼类OTU 156个,其中可准确注释到种的有70个,隶属于7目18科43属56种(表 1)。所有处理后的序列参考97%的OTU,对获得的12S rRNA的有效OTU使用网络公共数据库进行物种注释,计算生物类群的多样性指数。对鱼类组成进行分析,白马湖鱼类组成目级水平(图 2)以鲤形目(Cypriniformes)为主,主要有30种,占鱼类物种总数的60.32%,主要是、团头鲂、鲫等物种;其次是鲈形目(Perc-iformes),有16种,占物种总数的25.40%;鲇形目(Siluriformes)有4种,鳉形目(Cyprinodontiformes) 有2种,鲱形目(Clupeiformes)、颌针鱼目(Beloniformes)、鲑形目(Salmoniformes)各1种。科级水平上以鲤科(Cyprinidae)为主,共29种;其次为虾虎鱼科(Gobiidae),共7种。
| 表 1 基于eDNA技术的白马湖鱼类物种名录 |
|
图 2 白马湖目级水平鱼类物种组成 |
根据各采样点位监测到的鱼类物种数据(图 3)分析来看,鱼类物种数量最多的是S9点位,而在S3点位获得的鱼类物种数量最少,共有6个采样点的鱼类物种数超过物种总数的50%。从物种组成分析来看,共有15种鱼类在各采样点位均被检测出,主要包括、团头鲂、鲫、鲢、草鱼等鲤形目鱼类物种;而方氏鳑鲏(Rhodeus fangi)、高体鳑鲏(Rhodeus ocellatus)、尼罗罗非鱼(Oreochromis niloticus)和齐氏罗非鱼(Coptodon zillii)等只有2个以下采样点位检测到,低于样点总数的20%。

|
图 3 各采样点位鱼类物种数量 注:虚线表示物种总数的50%。 |
各采样点位鱼类多样性指数计算结果见表 2。由表 2可见,白马湖各点位H′值范围在1.084 1~3.169 0,最高值出现在白马湖东南侧S10点位,最低值出现在白马湖中部S6点位,平均值为2.338 8;J值范围在0.277 1~0.794 4,最高值与最低值同样分别出现在S10与S6点位,平均值为0.598 1;D值范围为4.612 1~7.741 2,最高值出现在S9点位,最低值出现在S3点位,平均值为6.082 4。
| 表 2 各采样点位鱼类多样性指数计算结果 |
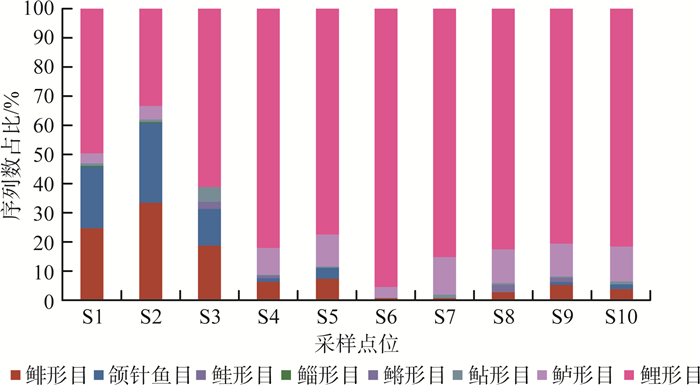
依据各点位统计数据计算鱼类序列相对丰度即物种序列数占总序列数百分比,见图 4。由图 4可见,白马湖鱼类群落总体以鲤形目为主,鲤形目的序列相对丰度最高约为85.48%,特别是在S6点位序列数占比>95%,其次是鲈形目;其中,鲤形目的(Hemiculter leucisculus)和团头鲂(Megalobrama amblycephala)的序列相对丰度较高,分别为29.8%和29.3%,其他物种均<10%。
|
图 4 各点位鱼类物种序列数占比 |
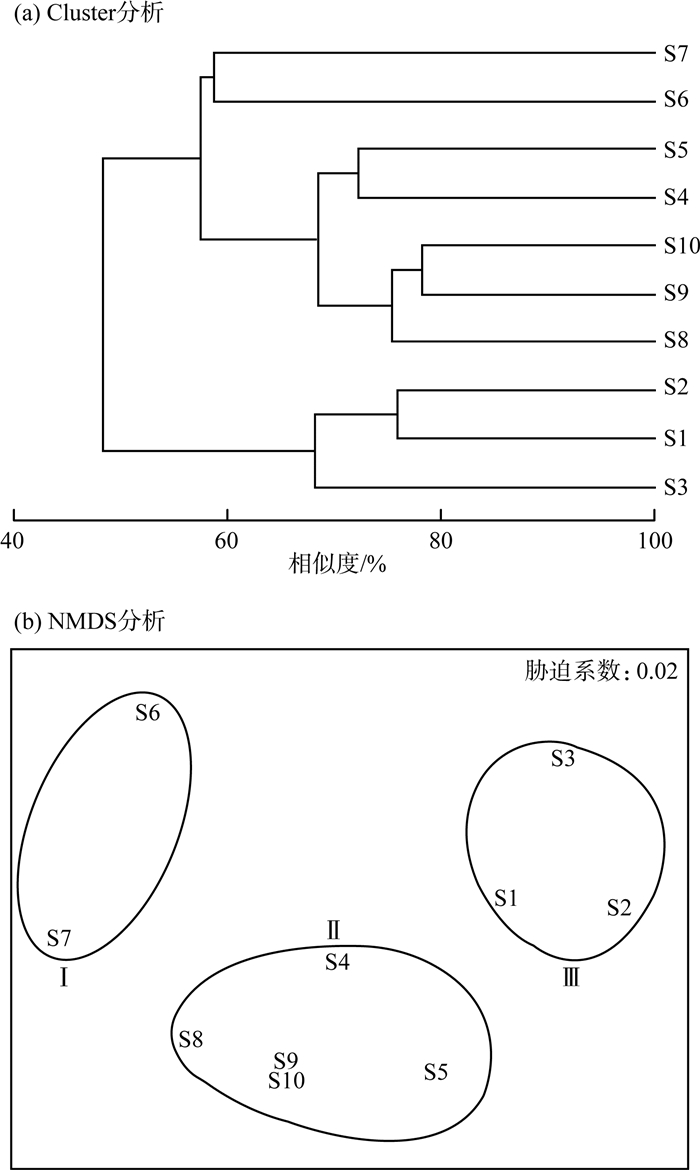
同时计算了各采样点之间的布雷柯蒂斯距离(Bray-Curtis Distance),并基于Bray-Curtis距离测度矩阵进行Cluster分析和NMDS分析,分析结果见图 5(a)(b)。
|
图 5 鱼类群落结构特征分析 |
由图 5可见,Cluster分析结果表明,在57.53%的Bray-Curtis相似性水平下,白马湖鱼类群落结构分为3个类群,类群Ⅰ为白马湖中部湖区S6、S7点位,类群Ⅱ为白马湖南部湖区S4、S5、S8—S10点位,类群Ⅲ为白马湖北部湖区S1、S2、S3点位。单向ANOSIM检验结果表明,3个类群的群落结构统计学上组间差异显著(P < 0.05),R值为0.802,组间差异>组内差异。NMDS分析中胁迫系数(Stress)=0.02,表明鱼类群落结构分类拟合效果较好,具有一定的解释意义。
3 讨论 3.1 eDNA与传统方法的比较基于分析结果与近年来利用捕捞方法统计调查的白马湖鱼类物种数据,比较了eDNA和传统调查方法之间鱼类物种组成和多样性结果之间的差别。利用传统捕捞方法共统计鱼类物种数量共69种,分属8目19科,利用eDNA技术共监测到鱼类56种,略低于传统方法。2种方法均监测到的物种共38种,物种检出一致率为67.85%,2种方法监测到的鱼类均主要以鲤形目鲤科为主。比较2种方法得到的鱼类组成,目级水平上来看,传统方法与eDNA均以鲤形目与鲈形目为主,eDNA未能检出合鳃鱼目(Synbranchiformes);科级水平上,eDNA发现了传统方法未能调查到的塘鳢科(Eleotridae)与太阳鱼科(Centrarchidae)的鱼类。
对比2种方法,eDNA单次调查鱼类物种检出数为56种,而传统方法单次调查检出鱼类物种数为30~40种,同时单个点位eDNA检出物种数量也显著高于传统方法,eDNA在检出效率方面高于传统捕捞方法,与文献[16]结论保持一致。从检出结果来看,2种调查方法在各点位优势鱼种以及区域常见鱼类物种的检出结果基本吻合,物种检出一致率为67.85%,其中共同检出到的38种鱼类序列数占全部检测序列数的89.62%,表明eDNA的检出结果具有一定的可靠性。
分析eDNA技术与传统方法在鱼类监测结果上存在差异的原因,一是eDNA能够检出丰度相对较低的鱼类,如鳡(Elopichthys bambusa)、河川沙塘鳢(Odontobutis potamophila)、尖头塘鳢(Eleotris oxycephala)等物种;二是鱼类参考数据库不全面从而影响eDNA检出结果,如尖头鲌(Culter oxycephalus)、亮银鮈(Squalidus nitens)等物种在美国国家生物技术信息中心(NCBI)等相关数据库中缺少目标物种序列;三是eDNA中的引物偏好影响检出,如合鳃鱼目合鳃鱼科黄鳝(Monopterusalbus)等物种无法使用脊椎动物通用引物扩增[17],导致无法检出。后续针对本地化鱼类线粒体DNA参考数据库构建和多组引物同时扩增等相关eDNA技术问题仍需要进一步研究。
3.2 白马湖鱼类多样性特征依据各采样点位的生物多样性指数计算结果,指数越高表明白马湖鱼类物种结构复杂度与稳定性越高[18]。白马湖鱼类多样性指数值为1.084 1~3.169 0,反映了白马湖鱼类多样性水平处于一般丰富水平[19],鱼类群落多样性结构受到人类活动的中度影响;综合Margalef丰富度指数与Pielou均匀度指数计算结果发现,白马湖南部鱼类多样性水平相对较高,白马湖北部相对较低,与传统方法调查结论类似,同时白马湖岸边鱼类多样性水平高于湖心鱼类多样性水平,这与文献[20—22]得出的结论一致。
Cluster分析和NMDS分析结果显示,在57.53%的相似性水平上,白马湖鱼类群落可以划分为Ⅰ、Ⅱ、Ⅲ 3个类群,按照空间位置可分别对应为白马湖中部湖区、南部湖区和北部湖区,且ANOSIM检验结果表明,鱼类群落结构存在显著差异,分组具有一定意义。通过计算白马湖湖区3个类群的鱼类多样性指数,分析不同分区的鱼类多样性水平,具体见表 3。由表 3可见,多样性指数结果从高到低表现为南部湖区>北部湖区>中部湖区,依据指数评价标准分析来看,南部湖区3个多样性指数值均为最高,表明白马湖南部鱼类物种丰富度较高,鱼类多样性水平也较高,而中部湖区多样性指数值均为最低,鱼类物种丰富度和多样性水平较低。分析原因内源上来看可能是,白马湖浮游动植物分布自北向南逐渐增加,浮游动植物能够为鱼类种群提供食物,同时白马湖地形特殊,湖体流动不畅,导致氮磷等营养盐成分在中部湖区累积,加快了厌氧气体产生[23];外源上来看,白马湖补水源主要为入湖河流,北部湖区周围生境主要为农田,人口较多、农业发达,大量污染物入湖导致北部湖区污染较重[24],影响鱼类生存,而南部湖区周围生境主要为自然湿地,污染排放量较少,水域开阔、水生植物茂盛,湖水自净能力较强,适宜鱼类生存。
| 表 3 3个分区鱼类多样性指数 |
(1) 重视白马湖湖区鱼类资源保护。鱼类是湖泊生态系统维持健康的重要因子,指示水环境的健康与否,同时白马湖是候鸟重要的栖息地,鱼类物种对于维持候鸟食物链稳定具有关键作用。目前白马湖水域实施为期4个月的禁渔制度,但在禁渔期非法垂钓、非禁渔期围网捕捞现象仍然存在,可见目前对白马湖部分区域保护重视程度不够。因此,有必要加强对白马湖湖区鱼类保护力度与重视程度。
(2) 加强白马湖鱼类科学监测。目前关于白马湖鱼类以及其他相关水生生物资源的公开历史资料与统计数据较为缺乏,利用鱼类评估白马湖水生态健康程度及水生生物的完整性很难开展,相关研究成果也较少。加强白马湖鱼类常规、科学监测,尤其是探索eDNA这种能满足大范围、稳定监测方法的运用以及后续的维持与改进,能够为白马湖生物多样性保护管理以及水生态健康维持提供科学依据。
(3) 科学评估白马湖鱼类资源的环境影响因子。鱼类分布与多样性变化受到环境因子的作用,对白马湖鱼类多样性水平以及群落结构特征进行分析,发现白马湖鱼类多样性水平呈现南高北低的明显特征,与白马湖水质空间分布趋势基本一致,因而科学评价不同环境因子与鱼类eDNA分子以及鱼类实际分布之间的相互影响机制,有助于白马湖生物多样性保护以及水生态健康评价。
| [1] |
REID A J, CARLSON A K, CREED I F, et al. Emerging threats and persistent conservation challenges for freshwater biodiversity[J]. Cambridge Philosophical Society, 2019, 94(3): 849-873. |
| [2] |
邢迎春, 高婉茹, 白洁, 等. 环境DNA在湖泊生物多样性研究中的应用[J]. 水生生物学报, 2022, 46(1): 137-148. |
| [3] |
张运林, 秦伯强, 朱广伟, 等. 论湖泊重要性及我国湖泊面临的主要生态环境问题[J]. 科学通报, 2022, 67(30): 3503-3519. |
| [4] |
WANG S, LUO B K, QIN Y J, et al. Fish isotopic niches associated with environmental indicators and human disturbance along a disturbed large subtropical river in China[J]. Science of The Total Environment, 2020, 750: 141667. |
| [5] |
方冬冬, 杨海乐, 张辉, 等. 长江中游鱼类群落结构及多样性[J]. 水产学报, 2023, 47(2): 154-170. |
| [6] |
蔡琨, 杨雅楠, 李旭文, 等. 基于环境DNA技术的江苏省鱼类群落监测应用初探[J]. 环境监控与预警, 2022, 14(2): 43-48. |
| [7] |
SU G, LOGEZ M, XU J, et al. Human impacts on global freshwater fish biodiversity[J]. Science, 2021, 371: 835-838. DOI:10.1126/science.abd3369 |
| [8] |
陈召松, 安蓓, 王子旺, 等. 黄河兰州段鱼类多样性与保护[J]. 生物多样性, 2021, 29(12): 1658-1672. DOI:10.17520/biods.2021199 |
| [9] |
REID A J, CARLSON A K, CREED I F, et al. Emerging threats and persistent conservation challenges for freshwater biodiversity[J]. Biological Reviews, 2019, 94(3): 849-873. DOI:10.1111/brv.12480 |
| [10] |
严太明, 何佳洋, 罗杰, 等. 基于鱼类多样性及完整性指数评价南河中上游流域健康状况[J]. 淡水渔业, 2021, 51(5): 3-12. |
| [11] |
李苗, 陈小勇. 环境DNA技术在鱼类生态学中的应用研究进展[J]. 生态学报, 2023, 43(17): 6951-6967. |
| [12] |
许龙飞, 姚邓雕, 郭星辰, 等. 基于环境DNA宏条形码的红枫湖鱼类多样性研究[J]. 水产学杂志, 2023, 36(4): 1-7. |
| [13] |
刘燕山, 孙晶莹, 朱明胜, 等. 基于eDNA技术的太湖鱼类多样性调查[J]. 生态毒理学报, 2023, 18(6): 16-26. |
| [14] |
郭宁宁, 沈梅, 肖能文, 等. 基于环境DNA技术的赤水河秋季鱼类多样性分布特征[J]. 生态学报, 2023, 43(4): 1676-1690. |
| [15] |
SHEN M, XIAO N W, ZHAO Z Y, et al. eDNA met-abarcoding as a promising conservation tool to monitor fish diversity in Beijing water systems compared with ground cages[J]. Scientific Reports, 2022, 12(1): 11113. |
| [16] |
BOHMANN K, EVANS A, GILBERT M T P, et al. Environmental DNA for wildlife biology and biodiversity monitoring[J]. Trends in Ecology & Evolution, 2014, 29(6): 358-367. |
| [17] |
高婉茹. 基于环境DNA的湖泊型水体鱼类多样性研究[D]. 上海: 上海海洋大学, 2023.
|
| [18] |
王银平, 匡箴, 蔺丹清, 等. 长江安庆新洲水域鱼类群落结构及多样性[J]. 生态学报, 2020, 40(7): 2417-2426. |
| [19] |
MAGURRAN A E. Ecological diversity and its measure-ment[M]. New Jersey: Princeton University Press, 1988.
|
| [20] |
HäNFLING B, LAWSON HANDLEY L, READ D S, et al. Environmental DNA metabarcoding of lake fish communities reflects long-term data from established survey methods[J]. Molecular Ecology, 2016, 25(13): 3101-3119. |
| [21] |
HAYAMI K, SAKATA M K, INAGAWA T, et al. Effects of sampling seasons and locations on fish environmental DNA metabarcoding in dam reservoirs[J]. Ecology and Evolution, 2020, 10(1): 5354-5367. |
| [22] |
周春花, 王蓉蓉, 王生, 等. 基于环境DNA宏条形码技术的赣江下游(南昌段)鱼类多样性[J]. 湖泊科学, 2023, 35(4): 1423-1440. |
| [23] |
施怀荣. 白马湖高锰酸盐指数超标成因分析[J]. 海河水利, 2024(2): 22-26. |
| [24] |
代丹, 李小菠, 胡小贞, 等. 白马湖水污染特征及其成因分析[J]. 长江流域资源与环境, 2018, 27(6): 1287-1297. |
 2024, Vol. 16
2024, Vol. 16 