2. 江苏宏众百德生物科技有限公司,江苏 无锡 214028
2. Jiangsu Metabio Science & Technology Co., Ltd., Wuxi, Jiangsu 214028, China
随着我国生态文明建设的不断推进,全社会对生态环境质量的要求不断提高。因此,水体富营养化问题以及由此引发的蓝藻水华现象已经成为全社会高度关注的生态环境质量话题[1-2]。蓝藻水华暴发会带来一系列生态环境危害及社会性问题,包括破坏水生态系统的稳定性,水质恶化并严重威胁周边地区的饮用水安全[3],引发了一系列蓝藻水华驱动因素的研究和思考[4-6]。蓝藻水华具有成因复杂、水域环境复杂、大面积覆盖水体、具备迁移性等特点,这使得传统的控制手段及治理措施存在诸多缺陷和限制[7-8]。因此,防治蓝藻水华重在监测与预警[3-9],通过掌握和分析蓝藻生长繁殖生态特性及演替规律,判断水华发展趋势,制定相应防治策略,为政府相关部门在制定生态环境保护、供水安全保障决策时提供科学支持。
当前,对蓝藻水华水体中藻类的检测主要采用人工镜检法、色素定量法等[2]。人工镜检法可以直接观测到水样中藻类形态、种群密度等特征,从而获取直观的藻类分类学与形态学信息,且镜检过程不易受水样情况干扰,鉴定结果准确度较高[10]。然而,人工镜检法存在检测周期长、鉴定效果依赖操作员素质等缺陷,因此难以满足大批量、快速分析蓝藻水华样本的要求[2]。色素定量法主要用于测定水体中叶绿素a的浓度,其反映了藻类的生物量,因此通常被用作评估水体中藻类现存量的重要参数,也是评价水体富营养化状况的主要指标。色素定量法主要分为分光光度法与荧光定量法[11],根据其分析原理的不同而有所区别。色素定量法的优点在于能够快速检测大批量水样,尤其是基于荧光定量法的荧光传感器,具有操作简便,可实现对水样的原位实时动态自动监测的优点。但该方法由于是以叶绿素作为目标检测物,并不能用于藻类的藻种和形态分析鉴定,所获取的信息相对单一,且该方法对水样条件要求较高,检测结果极易受藻量密度、藻团大小、水样条件等因素影响[12]。得益于人工智能技术的快速发展与广泛应用,藻类人工智能快速检测设备应运而生。作为一种新型藻类分析检测技术,藻类人工智能分析仪通过结合光学显微镜成像技术与人工智能图形识别技术[13-14],可实现藻种鉴定、形态表征、计数统计等分析项目,具有分析周期短、信息维度广、数据信息化、无人为误差等优点[13]。此外,该技术通过持续地优化藻类物种数据库和图形识别算法,不断提高鉴定准确性和分析速度,从而具备强大的环境适应能力和自纠错功能[15]。
本研究应用藻类人工智能快速检测技术,实现了对水体样本中藻种的准确、快速鉴定。该方法将藻类分类和计数时间从传统方法的每个样本2~3 h缩短至5~10 min,极大地提高了工作效率,较好地解决了当前传统藻类镜检效率低和专业人员紧缺等问题。此外,该方法还有助于获取海量、丰富的藻种组成及微囊藻形态学时空演变等大数据信息,对于开展更高精度的蓝藻水华预警工作具有重要意义。
1 材料与方法 1.1 样品采集太湖是中国第三大淡水湖,面积约为2 338 km2,是典型的浅水型湖泊,具有较为严重的蓝藻水华问题。2020年3—10月,对太湖蓝藻水华严重发生区的北部湖区开展每月2次的藻类样本采集,采样点位分布示意见图 1。
|
图 1 采样点位分布示意 |
根据《水质浮游植物的测定0.1 ml计数框-显微镜计数法》(HJ 1216—2021),利用AH-20-S型Algae-Hub藻类人工智能分析仪(江苏宏众百德生物科技有限公司),对经过预处理的藻类液体样品进行分析,进行藻种鉴定,识别优势藻种,并获取藻种形态学特征信息。通过Diameter 2022软件(江苏宏众百德生物科技有限公司)分析电子化图像,并获取不同藻类的粒径数据。使用WPS 2022进行数据统计整理,使用Origin 2019进行数据分析和图表绘制。
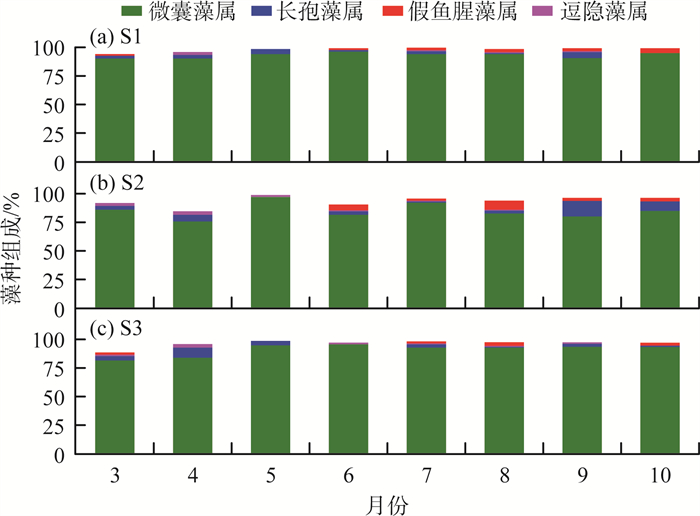
2 结果与分析 2.1 太湖藻种组成分析2020年3—10月太湖藻种组成月度变化见图 2(a)—(c)。由图 2可见,所有采集的样本中,微囊藻属都是第一优势种,优势度达57%。具体来说,2020年6月,S1、S2、S3点位的微囊藻属优势度达到最高,分别为97.6%,98.4%和96.7%。总体而言,微囊藻属的平均优势度为86.5%~94.2%,远高于假鱼腥藻、长孢藻等其他蓝藻门藻类。尽管不同采样点的微囊藻属优势度存在一定的地区差异,但均明显高于其他藻属,因此,微囊藻属是蓝藻水华的主要藻种,后文将以微囊藻为对象开展进一步分析。
|
图 2 2020年3—10月太湖藻种组成月度变化 注:图中仅列出优势度>1%的藻种。 |
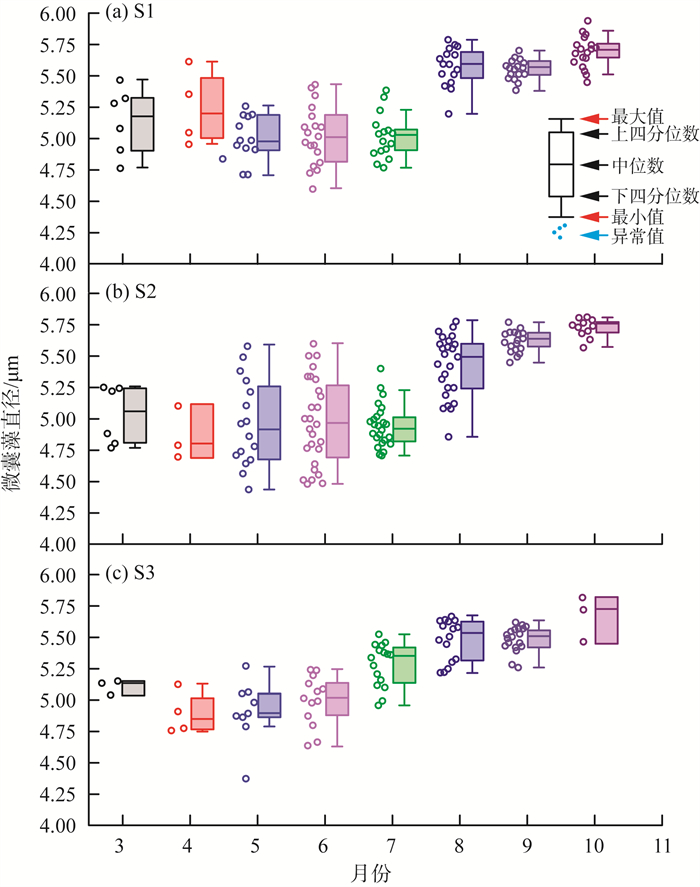
2020年3—10月太湖微囊藻细胞直径月度变化见图 3(a)—(c)。由图 3可见,3个点位的微囊藻细胞月平均直径整体均呈上升趋势。具体来说,3—6月,微囊藻细胞的平均直径在4.9~5.1 μm间小幅波动,7月以后,微囊藻细胞直径迅速增加,直至10月达到最高值,平均直径达到5.7 μm。从不同点位微囊藻直径的分布情况来看,尽管这3个采样点的微囊藻细胞平均直径变化趋势略有不同,但差异并不显著。
|
图 3 2020年3—10月太湖微囊藻细胞直径月度变化 |
研究表明,高温下,尤其是7月以后,惠氏微囊藻、铜绿微囊藻成为微囊藻属中的主要优势物种,更具竞争优势[16],此耐高温种类具有更大的细胞体积,群落演替规律与细胞直径变化趋势基本一致。
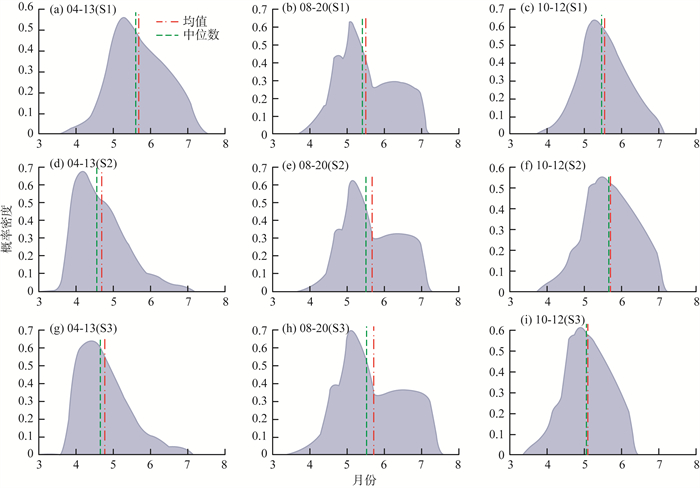
2020年3—10月太湖微囊藻细胞直径概率密度见图 4(a)—(i)。由图 4可见,8月份以前,微囊藻细胞直径的概率密度分布大多为单峰结构,其细胞直径平均值为4.7~5.6 μm。8月份以后,概率密度分布逐步变为双峰,并一直持续到9月中旬。在此之后,又逐步恢复为单峰,且细胞平均直径也变得更大,增加至5.5~5.8 μm。
|
图 4 2020年3—10月太湖微囊藻细胞直径概率密度图 |
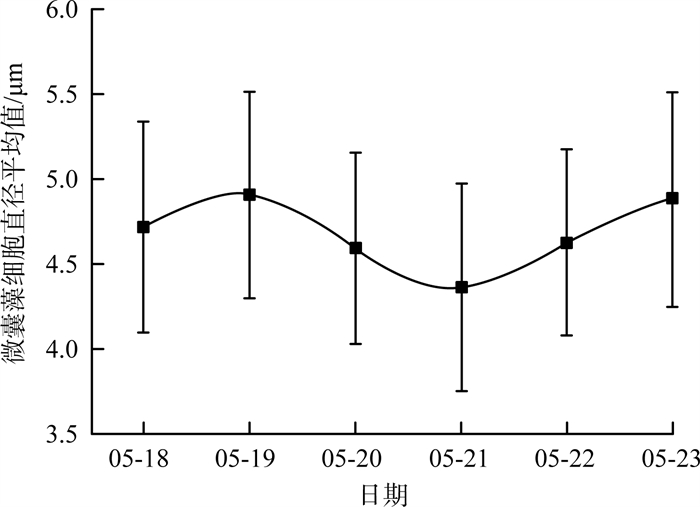
为了解微囊藻的日间形态变化规律,在3个点位进行了每日连续采样,并使用藻类人工智能分析仪快速获取了大量微囊藻样本的形态学数据。本研究选取了一段时间内的微囊藻细胞直径变化数据进行分析和展示。S2点位局部时段微囊藻细胞直径变化见图 5。由图 5可见,微囊藻细胞的日均直径呈现典型的峰谷周期性变化,具体来说,从5月18日的4.7 μm增加至5月19日的4.9 μm,随后下降至5月21日的4.3 μm,最后在5月23日再次回升至4.9 μm。这种细胞直径的波动可能表明,微囊藻细胞群在生长和繁殖优势之间交替进行。例如,从波峰至波谷表示微囊藻细胞群由生长优势向繁殖优势的转变,而从波谷至波峰则说明微囊藻细胞群由繁殖优势向生长优势转变。具体而言,5月18—19日,5月21—23日是S2点位微囊藻的生长优势期,而5月19—21日为微囊藻的繁殖优势期。
|
图 5 S2点位局部时段微囊藻细胞直径变化 |
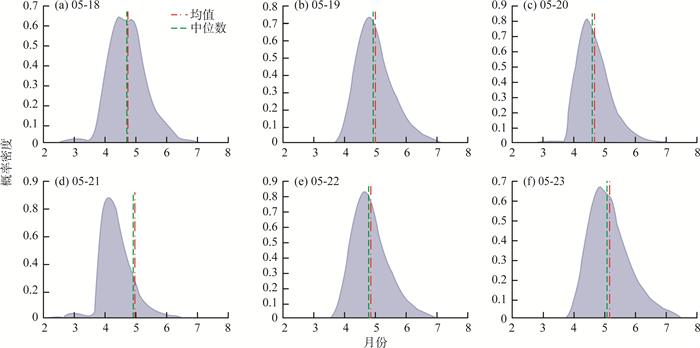
S2点位局部时段微囊藻细胞直径概率密度见图 6(a)—(f)。由图 6可见,细胞直径平均值在5月19日达到峰值,约为4.9 μm。随后,细胞直径的中位数和平均值开始下降,直到5月21日,平均值降至约4.4 μm,然后再次在5月23日回升至约4.9 μm的峰值。微囊藻细胞直径概率密度图所呈现趋势与图 5中的曲线一致,均表明S2采样点的微囊藻细胞群体在生长和繁殖优势之间交替变化,且这种变化周期约为2 d。
|
图 6 S2点位局部时段微囊藻细胞直径概率密度 |
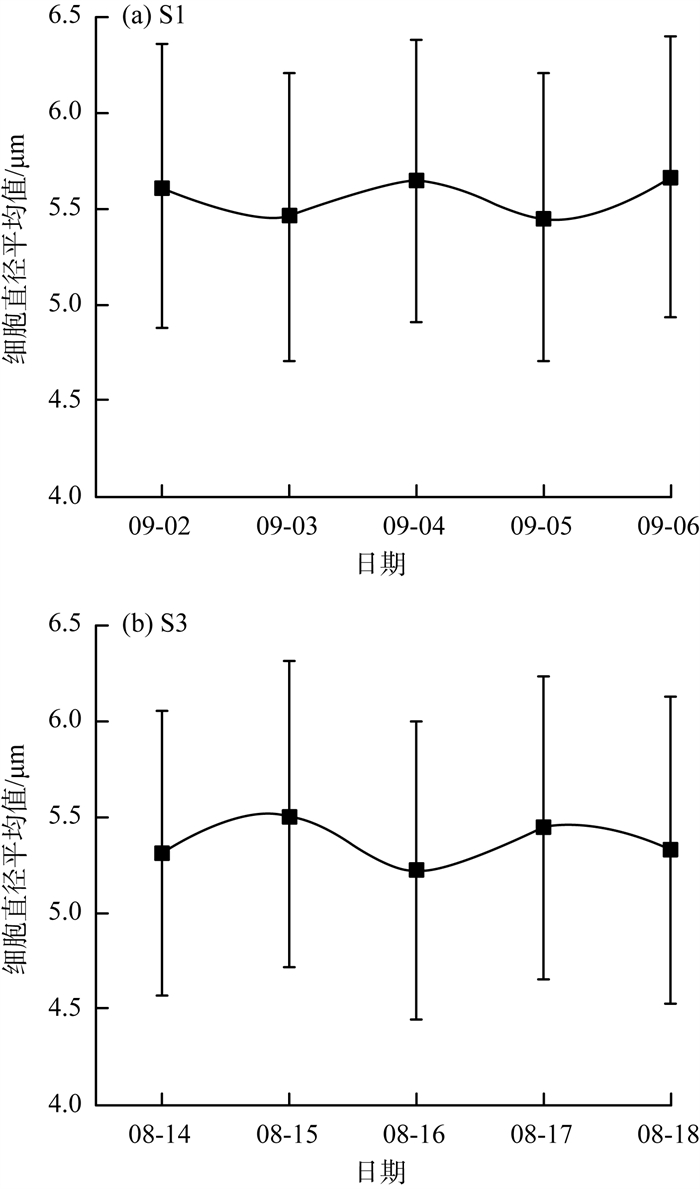
S1和S3点位局部时段微囊藻细胞直径变化见图 7(a)(b)。由图 7可见,S1和S3点位的微囊藻日均直径呈现周期性变化。其中S1点位的微囊藻在9月2—6日经历了2段繁殖优势期与2段生长优势期,其直径变化范围为5.4~5.7 μm。S3点位的微囊藻在8月14—18日也经历了2段繁殖优势期与2段生长优势期,其直径变化范围为5.2~5.5 μm。S1与S3点位的微囊藻群均表现为生长和繁殖优势状态的周期性交替,交替周期约为1 d。此外,通过将2个点位的微囊藻平均直径数据与S2点位进行对比,可以观察到明显增加的趋势。
|
图 7 S1和S3点位局部时段微囊藻细胞直径变化 |
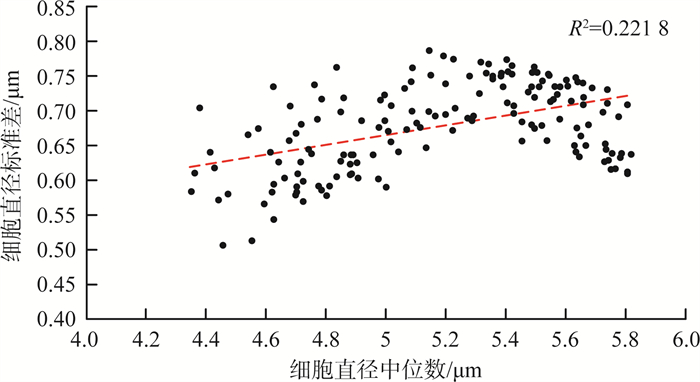
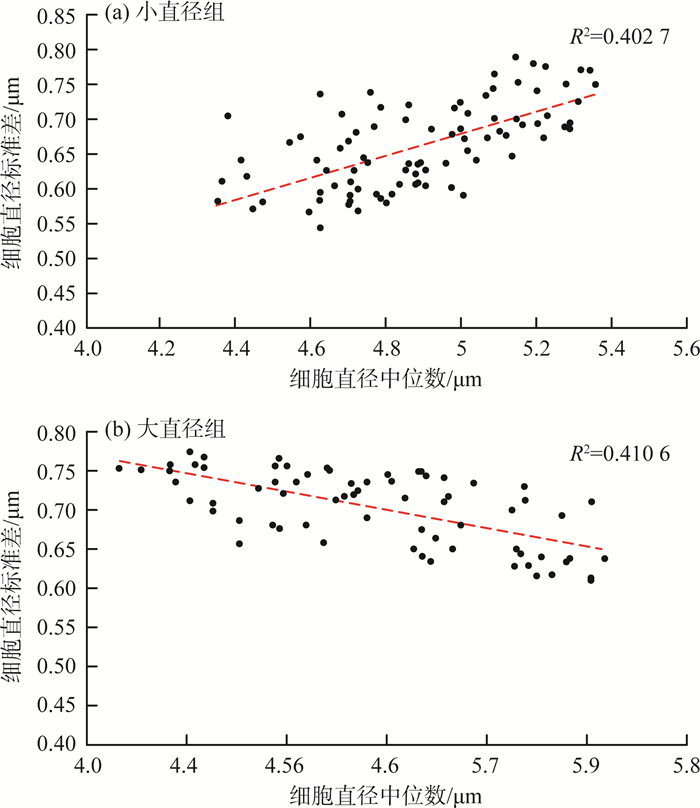
微囊藻细胞直径中位数与标准差散点图见图 8。由图 8可见,两者之间有一定的相关性,决定系数(R2)为0.221 8。该散点图在5.3 μm处于拐点,呈现出较为明显的分段特征,即细胞直径中位数<5.3 μm时单调递增,细胞直径中位数>5.3 μm时单调递减。
|
图 8 微囊藻细胞直径中位数与标准差散点图 |
以5.3 μm为界,分为小直径组和大直径组,微囊藻细胞直径中位数与标准差分段散点图见图 9(a)(b)。由图 9可见,小直径组中,微囊藻细胞直径中位数与微囊藻群体细胞标准差呈显著正相关,R2为0.402 7;大直径组中,微囊藻细胞直径中位数与微囊藻群体细胞标准差呈显著负相关,R2为0.410 6,均明显高于未分组时的R2(0.221 8)。
|
图 9 小直径与大直径组微囊藻细胞直径中位数与标准差分段散点图 |
(1) 微囊藻细胞平均直径的月度变化结果表明,微囊藻在历经数月的越冬期后,耗尽了其能量储备,因此,当微囊藻在休眠期后刚开始繁殖时,检测到的细胞直径明显较越冬前小。从4月开始,随着水温逐渐提高,加上充足的营养盐供应,微囊藻将吸收的能量主要用于迅速繁殖,因此细胞直径偏小。进入8月后,大量繁殖的蓝藻迅速消耗湖体中的营养盐,微囊藻此时改变其营养物质的利用策略[17],将能量主要用于生长过程,而不是储存,这种策略性调整可能导致了细胞直径的变化。10月以后,随着水温逐渐降低,在较低的温度条件下,微囊藻细胞直径增加可能是一种适应低温条件下生存的策略,表明其已开始累积能量以维持生存[18]。
(2) S1、S2与S3点位的微囊藻日均直径波动性变化揭示了太湖北部湖区中微囊藻群存在生长、繁殖优势交替进行的“小周期”现象。当微囊藻日均细胞直径下降时(即曲线由峰向谷变化),说明此时微囊藻群体中直径偏小的细胞在增加,大量细胞进入分裂状态,这一时段微囊藻细胞繁殖占优势[18];反之,当微囊藻日均细胞直径上升时,即曲线由谷向峰变化,说明此时微囊藻群体中直径偏大的细胞在增加,大量细胞进入生长状态,这一时段微囊藻细胞生长占优势,老年期细胞在增加[19]。进一步分析发现,不同月份选取的3个点位的微囊藻日均直径变化数据存在差异性,具体来说,5月份S2点位的微囊藻生长、繁殖优势状态交替变化周期约为2 d,而S1与S3这2个点位为1 d,造成这种差异的原因可能与气温、光照等因素有关。S1与S3这2个点位选择的是8—9月的数据,此时太湖区域气温高于5月,藻类的生长、繁殖、代谢活性更快[17],从而导致微囊藻群体的生长、繁殖优势状态交替周期缩短。同时,太湖不同湖区的水体理化指标和气候条件也存在差异性,这也可能对微囊藻的生存状态产生不同影响。5月份S2点位的微囊藻细胞直径日均数值(4.4~4.9 μm)显著低于8月份的S3点位,以及9月份的S1点位(5.2~5.5 μm和5.4~5.7 μm)。S3和S1点位微囊藻日均细胞直径数值的显著变化与7月后太湖区域内微囊藻藻种演替变化有关[16]。高温下,具有更大细胞体积的惠氏微囊藻、铜绿微囊藻等成为竞争优势种,因此8,9月份S3和S1这2个点位的微囊藻细胞直径日均数值相较于5月份S2点位显著增加,此时段的微囊藻细胞直径概率密度图也出现了双峰现象。
(3) 通过微囊藻细胞直径的标准差特征分析,细胞直径中位数(5.3 μm)很有可能表征和分离了微囊藻细胞群体快速繁殖期和生长期2种不同的生长状态。即微囊藻细胞直径<5.3 μm,细胞整体上处于分裂期,随着大量细胞分裂导致群体波动性上升;微囊藻细胞直径>5.3 μm,细胞整体上处于生长期,较少的细胞分裂导致群体波动性的持续下降。
4 展望在对太湖北部湖区中微囊藻属的种群演替和生长繁殖特性进行初步分析后,可以进一步研究微囊藻“大周期”和“小周期”细胞直径大小变化特征,以便展开精细化的蓝藻预警和打捞工作。后续研究可深入分析微囊藻的生长繁殖小周期变化规律,特别是小周期交替进行的特点,并有针对性地开展蓝藻水华预警和防治工作。在湖泊治理时,可以采取针对性措施,例如,人工调控水文条件,以将藻类置于生长与繁殖的抑制状态[20],从而延长或缩短繁殖与生长的优势阶段,以及时预防控制因蓝藻大量聚集繁殖而导致的水华现象。同时,蓝藻作为太湖的初级生产者,在快速生长期,能够大量吸收湖体中的营养物质,其生长旺盛期光合作用强度可在数小时内让湖泊内无机碳浓度显著下降[21]。而当细胞从生长期到衰亡期时,则需要加大力度进行蓝藻的控制和打捞工作,避免蓝藻水华颗粒衰亡使得水体中有机物浓度增加[22],从而造成湖泊“内源污染”。当然,深入研究微囊藻的种群演替与生长繁殖特性,并指导湖泊治理,还需要更深入的探讨,这可以通过实验室藻类纯化培养,进行参数指标单因素试验分析,结合野外模拟实验等工作来进一步实现,从而为太湖蓝藻的预警和湖泊治理提供更为坚实的理论基础。
| [1] |
PAERL H W, HUISMAN J. Blooms like it hot[J]. Science, 2008, 320: 57-58. DOI:10.1126/science.1155398 |
| [2] |
钟声. 太湖蓝藻水华的自动监测和手工监测比对分析[J]. 环境监控与预警, 2021, 13(3): 19-23. |
| [3] |
徐恒省, 洪维民, 王亚超, 等. 太湖蓝藻水华预警监测技术体系的探讨[J]. 中国环境监测, 2008, 24(2): 62-65. |
| [4] |
PAERL H W, HUISMAN J. Climate change: A catalyst for global expansion of harmful cyanobacterial blooms[J]. Environmental Microbiology Reports, 2009, 1: 27-37. DOI:10.1111/j.1758-2229.2008.00004.x |
| [5] |
张民, 阳振, 史小丽. 太湖蓝藻水华的扩张与驱动因素[J]. 湖泊科学, 2019, 31(2): 336-344. |
| [6] |
QIN B Q, ZHU G W, GAO G, et al. A drinking water crisis in Lake Taihu, China: Linkage to climatic variability and lake management[J]. Environmental Management, 2010, 45(1): 105-112. DOI:10.1007/s00267-009-9393-6 |
| [7] |
ZHANG X, XIE P, HUANG X P, et al. A review of nontraditional biomanipulation[J]. The Scientific World Journal, 2008, 8: 1184-1196. DOI:10.1100/tsw.2008.144 |
| [8] |
王敏, 刘浩, 王江南, 等. 生物法治理蓝藻水华研究进展[J]. 环境工程技术学报, 2022, 12(1): 92-99. |
| [9] |
张民, 史小丽, 阳振, 等. 2012—2018年巢湖水质变化趋势分析和蓝藻防控建议[J]. 湖泊科学, 2020, 32(1): 11-20. |
| [10] |
KOMÁREK J, KOMÁRKOVÁ J. Review of the European microcystis-morphospecies(Cyanoprokaryotes) from nature[J]. Czech Phycology, 2002, 2: 1-24. |
| [11] |
GREGOR J, MARSALEK B, SIPKOVA H. Detection and estimation of potentially toxic cyanobacteria in raw water at the drinking water treatment plant by in vivo fluorescence method[J]. Water Research, 2007, 41: 228-234. DOI:10.1016/j.watres.2006.08.011 |
| [12] |
KONG Y, LOU I, ZHANG Y, et al. Using an online phycocyanin fluorescence probe for rapid monitoring of cyanobacteria in Macau freshwater reservoir[J]. Hydrobiologia, 2014, 741: 33-49. DOI:10.1007/s10750-013-1759-3 |
| [13] |
胡圣, 刘浩兵, 刘辉, 等. 基于深度学习技术的藻类智能监测系统开发[J]. 中国环境监测, 2022, 38(1): 200-210. |
| [14] |
汪振兴, 佘焱, 姜建国. 赤潮藻类图像自动识别的研究[J]. 海洋环境科学, 2007, 26(1): 42-44. |
| [15] |
程钊, 赵南京, 殷高方, 等. 基于多任务卷积神经网络的浮游藻类群落识别方法[J]. 光学学报, 2022, 42(5): 1-9. |
| [16] |
朱冰川, 黄君, 宋挺, 等. 太湖蓝藻水华种类及其演替规律研究[C]//中国环境科学学会学术年会论文集(第五章), 2014: 4435-4440.
|
| [17] |
杨柳燕, 杨欣妍, 任丽曼, 等. 太湖蓝藻水华暴发机制与控制对策[J]. 湖泊科学, 2019, 31(1): 18-27. |
| [18] |
徐良, 冯平, 孙冬梅, 等. 水温对藻类生长变化影响的数值模拟[J]. 安全与环境学报, 2013, 13(5): 76-81. |
| [19] |
黄晓琛. 藻类生长过程中的生态特性及水华预测方法研究[D]. 上海: 上海交通大学, 2009: 17-60.
|
| [20] |
黄鹏, 田腾飞, 张文安, 等. 水动力条件对水体中藻类生长的抑制作用[J]. 环境工程, 2018, 36(12): 64-69. |
| [21] |
HEIN M. Lnorganic carbon limitation of photosynthesisin lake phytoplankton[J]. Freshwater Biology, 2010, 37(3): 545-552. |
| [22] |
ZHU M Y, ZHU G W, NURMINEN L, et al. The influence of macrophytes on sediment resuspension and the effect of associated nutrients in a shallow and large lake(Lake Taihu, China)[J]. PLoS One, 2015, 10(6): e0127915. DOI:10.1371/journal.pone.0127915 |
 2024, Vol. 16
2024, Vol. 16 