环境水质监测是保证水环境健康、可持续发展的必要手段之一。由于水质会受到水体各种污染物之间的复杂作用及生物利用度等因素的综合影响,水质监测不仅要关注环境水体的理化参数[1-2],还须评估水体对水生生物的综合毒性。因此,近年来生物毒性测试方法逐渐被应用到水质监测领域[3-4]。
费氏弧菌(Aliivibrio fischeri)是一种常见的海洋发光细菌,是国际化标准组织(International Organization for Standardization,ISO)推荐的水质生物毒性检测的标准物种之一,在环境污染物的生物毒性评估、水质毒性评价和应急监测等方面应用广泛[3, 5]。目前菌种的商品化发展已十分成熟。相较于藻类生长抑制试验、溞类活动抑制试验及鱼类急性毒性试验等其他生物毒性监测方法[6-8],发光细菌毒性测试方法具有时效快、反应灵敏度高等显著优势[9-10]。
现通过改进传统的单管式发光细菌毒性测试方法,测定了费氏弧菌菌悬液在高通量测试体系中的发光强度动力学数据和发光强度的校正因子,评价了费氏弧菌在高通量测试体系中的稳定性。通过评估长三角示范区水乡客厅及周边“一河三湖”区域环境水体对费氏弧菌的急性毒性效应,并根据国际水质毒性分级采用的毒性单位(Toxic Unit,TU)对水质进行毒性分级[11],对方法的适用性进行验证。在此过程中,高通量发光细菌毒性测试方法表现出了较好的稳定性和适用性,在水质生物毒性监测和水质分级评价方面应用前景良好。
1 实验部分 1.1 仪器与试剂仪器:ME204E/02电子分析天平(瑞士Mettler Toledo公司);Multi 9430多参数水质分析仪(德国WTW公司);200 μL、1 mL、5 mL、10 mL单通道移液器,200 μL多通道移液器(德国Eppendorf公司);漩涡混匀器(德国IKA公司);AutoTrace 280固相萃取仪(美国Thermo Fisher公司);Oasis prime小柱(美国Waters公司);Multivap TM 6166氮吹仪(美国Organomation公司);Orion Ⅱ发光检测仪(德国Berthold公司);SC-329GA冰箱(青岛海尔股份有限公司);TS-211GZ恒温培养箱(上海万柏生物科技有限公司);SW-G68型GPS测亩仪(广州速为电子科技有限公司)。
试剂:氯化钠(NaCl)、七水硫酸锌(分析纯,国药集团化学试剂有限公司);3,5-二氯苯酚、重铬酸钾[分析纯,阿拉丁试剂(上海)有限公司];甲醇(色谱纯,德国默克公司);环境水样采自长三角示范区水乡客厅及周边“一河三湖”(太浦河、淀山湖、元荡、汾湖)区域;实验室用水为默克Milli-Q IQ 7000型超纯水机所制的一级水。费氏弧菌(Aliivibrio fischeri NRRL B-11177)冻干粉(-20~-18 ℃冷冻保存,湖南碧霄环境科技有限公司);不透光无菌96孔板(上海安谱实验科技股份有限公司)。
1.2 发光细菌悬液在高通量测试体系中的稳定性从冰箱中取出冻干粉小瓶和菌体复苏液(2%的NaCl),将310 μL菌体复苏液快速倒入冻干粉小瓶,并使用涡旋混合器充分混匀,复苏15 min后作为发光细菌母液。用2%的NaCl将发光细菌母液分别制备成稀释10,50,100,500和1 000倍的发光细菌悬液。在96孔板中分别加入100 μL各稀释浓度的发光细菌悬液,每个浓度2个平行。连续测定75 min内发光细菌悬液的发光强度动力学数据和发光强度的校正因子。
1.3 发光细菌急性毒性试验 1.3.1 采样方法采用大体积主动采样方式采集各采样点环境水样,以提高生物分析数据与常规化学分析数据的匹配性。在研究区域共设置12个采样点,采样点覆盖国考与市考断面。采样点布设参考《地表水环境质量监测规范》(HJ 91.2—2022)[12]。采样点信息见表 1。
| 表 1 采样点信息 |
将每个采样点采集的80 L水样用直径为47 mm的玻璃纤维滤膜进行过滤,选用Oasis prime小柱进行固相萃取,上样流速为20 mL/min,萃取结束后氮吹15 min,用80 mL甲醇完全洗脱,得到浓缩倍数为1 000的各采样点水样甲醇萃取液。每个采样点各取10 mL萃取液,经氮吹后用20 mL 2%的NaCl进行定容,超声30 min后获得浓缩倍数为500的环境水样浓缩液。
1.3.3 样品和参比样品溶液的制备采用交叉稀释法,使用2%的NaCl溶液进行稀释以获得各浓缩水样系列浓度梯度的试验溶液[13][图 1(a)(b)]。稀释完成后的样品测试溶液体积分数分别为浓缩水样的4.17%,6.25%,8.33%,12.5%,16.7%,25.0%,33.3%,50.0%,66.7%和100%(C1—C10)。
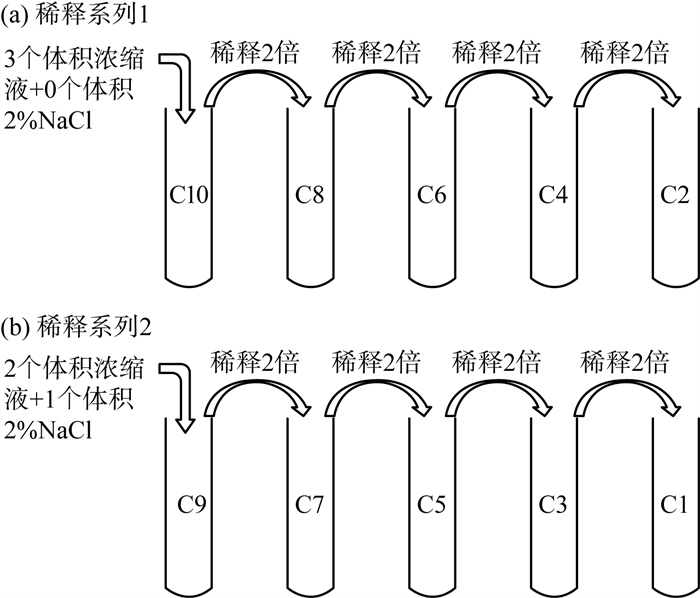
|
图 1 交叉稀释法制备试验溶液示意 |
参比样品选用3,5-二氯苯酚、七水硫酸锌、重铬酸钾3种物质,母液的配制质量浓度分别为20.4,29.0,211.6 mg/L,同样采用交叉稀释法获得参比样品各浓度梯度的试验溶液。
1.3.4 发光细菌复苏和菌悬液平衡将复苏15 min后的发光细菌母液用发光检测仪测定发光强度后,用2%的NaCl进行稀释,充分混匀后测定菌悬液的发光强度。重复上述步骤直至达到合适的发光强度(约2×105 RLU/s,RLU为相对发光单位)。将发光细菌悬液置于15 ℃的培养箱内平衡30 min。
1.3.5 测定发光强度将平衡好的发光细菌悬液用多通道移液器移至不透光的96孔板中,每个浓度组2个平行,每孔100 μL菌悬液,最高浓度组每孔40 μL菌悬液,空白对照组同样设置添加100和40 μL菌悬液的2种体系,测试各孔的初始发光值(I0)。将稀释后的浓缩水样和参比样品试验溶液分别添加至96孔板相应孔中,每孔100 μL试验溶液,最高浓度组每孔160 μL试验溶液,最终试验体系中样品最高测试浓度为最高浓度的80%。用2%的NaCl代替试验溶液,添加至对应试验体系的空白对照组试验孔中。置于15 ℃的培养箱反应30 min,测试各反应孔的发光细菌发光值(I30)[13]。
1.3.6 计算发光强度的相对抑制率根据公式(1)计算各环境浓缩水样对费氏弧菌发光强度的相对抑制率。
| $ H_t=\left(I_{\mathrm{ct}}-I_t\right) / I_{\mathrm{ct}} \times 100 \% $ | (1) |
式中:Ht——测试样品的相对抑制率,%;Ict——添加样品前的校正值,RLU;It——反应t时间后,样品的发光强度,RLU。
其中,Ict可通过公式(2)和公式(3)获得。
| $ I_{c t}=I_0 \times \bar{f}_{\mathrm{k} t} $ | (2) |
式中:I0——添加样品前的发光强度,RLU;fkt——fkt的平均值。
| $ f_{\mathrm{k} t}=I_{\mathrm{k} t} / I_{\mathrm{k} 0} $ | (3) |
式中:fkt——反应时间为t时的校正因子;Ikt——反应t时间后,空白对照的发光强度,RLU;Ik0——空白对照的初始发光强度,RLU。
浓缩水样发光细菌急性毒性浓缩倍数见表 2。
| 表 2 浓缩水样发光细菌急性毒性浓缩倍数 |
由表 2可见,采样点5号—12号的浓缩500倍环境水样对发光细菌的急性毒性较强,将浓缩水样最低端2个浓缩倍数的试验溶液继续进行交叉稀释后,按照1.3.3至1.3.5中的试验步骤进行试验。
2 结果与讨论 2.1 发光细菌悬液在高通量测定体系中的稳定性评价不同稀释倍数的发光细菌发光强度动力学数据和各时刻校正因子见表 3。由表 3可见,各稀释倍数菌悬液的发光强度在0~15 min呈明显上升趋势,15 ~30 min左右发光强度基本稳定。30 min后,随着时间的延长,发光强度逐渐衰减。75 min内,校正因子平均值的变化范围为0.78~1.10。发光细菌在高通量测试体系中能够保持稳定的发光强度。进一步分析可知,稀释500和1 000倍的菌悬液的发光强度与96孔板空孔的发光强度(本底值)相差不超过一个数量级,发光强度的抑制区间有限。此外,稀释10和50倍的菌悬液在75 min内校正因子变化范围均小于稀释倍数为100的菌悬液,发光强度的稳定性较好,且考虑到菌悬液的耗费,建议使用稀释50倍左右的菌悬液用于测试。另外,发光细菌毒性测试的国际标准方法建议菌悬液的平衡时间≥15 min[13]。分析稀释50倍的菌悬液各时刻发光强度的校正因子可知,菌悬液在15 ~30 min内的发光强度较稳定,且考虑毒性测试的时效性,建议菌悬液的平衡时间为15 ~30 min。因此,选择初始发光强度约为2×105 RLU/s(稀释倍数约为50)、平衡时间为15 ~30 min的菌悬液用于发光细菌高通量毒性测试是可行的。
| 表 3 不同稀释倍数的发光细菌发光强度动力学数据和各时刻校正因子 |
12个采样点的环境浓缩水样对费氏弧菌30 min高通量急性毒性结果表明,在相应的试验浓度下,各浓缩水样对费氏弧菌发光强度产生了不同程度的抑制作用。各采样点环境水样对费氏弧菌的30 min发光强度相对抑制率及急性毒性见表 4。使用数据处理软件ToxRatPro Version 3.3.0得出各采样点浓缩水样对费氏弧菌发光强度抑制的20%效应浓度(EC20)和50%效应浓度(EC50)。
| 表 4 各采样点环境水样对费氏弧菌的30 min发光强度相对抑制率及急性毒性 |
由表 4可见,12个采样点的浓缩环境水样对费氏弧菌发光强度30 min的相对抑制率为20%~80%,发光强度与浓缩水样的浓缩倍数表现出了强相关关系。EC20和EC50的置信限区间较窄,不超过1个数量级,数据拟合结果良好。根据试验获得的各试验组发光细菌的发光强度,所有测试样品各平行间相对发光抑制率的相对偏差范围为-1.9%~1.9%,平行之间的差异较小,发光细菌高通量毒性测试试验体系较稳定。
2.3 环境水样的水质分级国际上水污染物排放管理中一般采用毒性单位“TU”进行废水对不同能量级生物的综合毒性评估[14]。排入水环境中的废水水质急性毒性分级[11]见表 5。
| 表 5 排入水环境中的废水水质急性毒性分级 |
浓缩水样的TU值为产生50%效应的水样浓缩倍数的倒数。环境水样对水生生物的慢性效应预测水平和可忽略效应的预测水平分别为TU > 0.05(产生50%效应的浓缩倍数<20)和TU < 0.005(产生50%效应的浓缩倍数>200)[15]。根据表 4中EC50拟合结果,计算12个采样点环境水样的TU值,结果见表 6。由表 6可见,各采样点环境水样TU值范围为0.007~0.11,各采样点的水质毒性分级均为Ⅰ类,对发光细菌无急性毒性。由于采样点8,10和11号环境水样的TU值均>0.05,预测可能会对水生生物产生慢性毒性效应。其余9个采样点包括长三角示范区不同类型的地表水,如河流(包括上下游水域、居民生活区水域)、湖泊以及示范区内的工业园区地表水等,水质毒性分级均为Ⅰ类,对发光细菌无急性毒性,环境水样的TU值范围为0.007~0.05,预测对水生生物无慢性毒性效应。采样点2环境水样的TU值(0.007)接近0.005,水质对环境的风险可忽略。
| 表 6 各采样点环境水样TU值 |
此外,根据我国国家标准《水质急性毒性的测定发光细菌法》(GB/T 15441—1995)及国内相关研究,一般认为EC50值>70%,即HgCl2毒性当量 < 0.07 mg/L的水质毒性分级为Ⅰ级,对发光细菌的急性毒性级别为低毒[16-17]。长三角示范区水乡客厅及周边区域12个采样点的环境水样对发光细菌发光抑制的EC50值均>100%。因此,12个采样点的环境水样水质毒性分级均为Ⅰ类,毒性级别为无毒,目前环境风险较小。
结合12个采样点的地理位置信息及主营业务来看,以采样点2和采样点10为例进行探讨。由于采样点2毗邻火泽荡,周边水域网丰富,园内主营五金、照明、雕刻等业务,不存在对环境高污染、高排放的风险行业,水质毒性分级为Ⅰ类,对发光细菌无急性毒性,TU值较其他采样点的水样低一个数量级,水质较好,对环境无风险。采样点10主营新材料、塑料产品等生产业务,产品的生产加工过程中会产生较多的“三废”,如塑料颗粒物、一氧化碳、二噁英、油墨挥发物等。随着大气和水体之间的物质交换,势必对附近的地表水水质产生一定的影响。因此,尽管嘉善工业园的水质毒性分级划分为Ⅰ类,但是其环境水样的TU值已经达到0.11,相当于水生生物的慢性效应预测水平的2.2倍,存在可能对水生生物造成慢性毒性效应的隐患。
综上所述,高通量发光细菌毒性测试方法不仅可以快速地对环境水质进行毒性分级,还能够有效识别环境水体更深层级的生态风险,在生态风险的预防预警和水质应急监测方面的应用效果良好。
2.4 方法质量控制高通量发光细菌急性毒性测试结果显示,参比物质3,5-二氯苯酚、七水硫酸锌和重铬酸钾的质量控制浓度点(3.4 mg/L的3,5-二氯苯酚、2.42 mg/L的七水硫酸锌以及52.9 mg/L的重铬酸钾)对费氏弧菌发光强度的相对抑制率范围分别为34.4%~48.6%,52.4%~71.9%和46.6%~68.9%,相对抑制率满足20%~80%的有效范围[13]。空白对照组费氏弧菌发光强度30 min的校正因子fkt值为0.43~0.66,满足0.4~1.8的方法要求[18]。所有测试样品各平行间的相对抑制率的相对偏差范围为-1.9%~1.9%(<10%)[13],试验结果有效。
3 结语与传统的单管式发光细菌毒性测试方法比较,高通量发光细菌毒性测试方法具有以下3个方面的显著优势。
(1) 提高试验体系制备效率。传统的单管式发光细菌毒性测试体系的制备相对繁琐,以应用广泛的MicroTox为例[19-20],每个反应体系需要单独制备,样品稀释过程复杂,各反应管的菌液须分别添加,试验体系制备效率低。相比之下,高通量发光细菌毒性测试方法通过交叉稀释法制备各浓度梯度样品溶液,菌悬液和样品溶液可通过多通道移液器添加至96孔板,大大提高了试验体系的制备效率。
(2) 增大测试样品通量。传统的单管式发光细菌毒性测试单次进样只能测定单个反应管内发光细菌的发光强度,而高通量发光细菌毒性测试方法单次进样可测定近百个反应孔内发光细菌的发光强度,且通过设定仪器检测方法可实现试验周期内各反应孔发光强度的连续监测,能较好地揭示毒性作用过程的变化规律。
(3) 提高数据准确性和重复性。传统的单管式发光细菌毒性测试方法的孔间测试间隔时间无法做到精确控制。相比之下,高通量发光细菌毒性测试方法可通过仪器设置孔间测试间隔时间,保证了各反应孔毒性作用时间的一致性,数据的准确性更高。另外,研究表明,MicroTox测试数据各平行发光强度的变异系数范围为5%~10%[21],而本研究中采用高通量发光细菌法获得的各浓缩水样和参比物质各平行发光强度的变异系数范围为0.01%~5.62%,数据的重复性更好。
综上所述,高通量发光细菌毒性测试方法在提高试验体系制备效率、增大测试样品的通量及提高数据准确性和重复性等方面优势显著。未来在环境水体的微体系、低成本、大通量、高时效的水质监测方面应用前景广阔。
| [1] |
周敏, 邵迎, 冯强, 等. 基于生物导向的水生态健康监测及评估概述[J]. 环境监控与预警, 2022, 14(5): 39-48. |
| [2] |
张雪莉. 环境管理中的水环境监测及其保护研究[J]. 资源节约与环保, 2023(11): 58-61. |
| [3] |
朱丽娜, 刘瑞志, 夏建新, 等. 发光细菌法测定水质综合毒性研究进展[J]. 中央民族大学学报(自然科学版), 2011, 20(4): 14-20. |
| [4] |
生态环境部. 水质急性毒性的测定斑马鱼卵法: HJ 1069—2019[S]. 北京: 中国环境出版集团, 2019.
|
| [5] |
李再兴, 尹青, 赵俊娜, 等. 发光细菌法测定水质急性毒性研究进展[J]. 河北科技大学学报, 2014, 35(5): 480-486. |
| [6] |
Organization for Economic Cooperation and Development. OECD Guidelines for the Testing of Chemicals, 201 Alga Growth of Inhibition Test[S]. Paris: OECD, 2011.
|
| [7] |
Organization for Economic Cooperation and Development. OECD Guidelines for the Testing of Chemicals, 202 Daphnia sp., Acute Immobilisation Test[S]. Paris: OECD, 2004.
|
| [8] |
Organization for Economic Cooperation and Development. OECD Guidelines for the Testing of Chemicals, 203 Fish, Acute Toxicity Test[S]. Paris: OECD, 2019.
|
| [9] |
QURESHI A A, ANTHONY A B, DON L I. Microtox toxicity test systems—where they stand today.Microscale testing in aquatic toxicology[M]. Boca Raton: CRC Press, 2018: 185-199.
|
| [10] |
JOHNSON B T. Microtox toxicity test system—new developmen-ts and applications.Microscale testing in aquatic toxicology[M]. Boca Raton: CRC Press, 2018: 201-218.
|
| [11] |
PERSOONE G, MARSALEK B, BLINOVA I, et al. A practical and user-friendly toxicity classification system with microbiotests for natural waters and wastewaters[J]. Wiley Inter Science, 2003, 18(6): 395-402. |
| [12] |
生态环境部. 地表水环境质量监测规范: HJ 91.2—2022[S]. 北京: 中国环境出版集团, 2022.
|
| [13] |
Water quality-Determination of the inhibitory effect of water samples on the light emission of Vibrio fischeri(Luminescent bacteria test) -Part 3: Method using freeze-dried bacteria: ISO 11348—3[S]. Switzerland: ISO, 2007.
|
| [14] |
任春, 卢延娜, 张虞, 等. 综合毒性指标在水污染物排放标准中的应用探讨[J]. 工业水处理, 2014, 34(12): 4-7. |
| [15] |
DURAND A M, ROTTEVEEL S, COLLOMBON M T, et al. Toxicity measurements in concentrated water samples. Evaluation and validation[R]. RIVM rapport 607013010, 2009: 62.
|
| [16] |
国家环境保护局, 国家技术监督局. 水质急性毒性的测定发光细菌法: GB 15441—1995[S]. 北京: 中国标准出版社, 1995.
|
| [17] |
岳舜琳. 用发光细菌监测水质突发性污染[J]. 净水技术, 2008, 27(1): 65-68. |
| [18] |
上海市环境科学学会, 江苏省环境监测协会, 浙江省环境监测协会. 水质急性毒性高通量发光细菌测试方法: T/SSESB 6—2023 T/JSEMA 3—2023 T/ZJEMA 2—2023[S]. 2023.
|
| [19] |
TIGINI V, GIANSANTI P, MANGIAVILLANO A, et al. Evaluation of toxicity, genotoxicity and environmental risk of simulated textile and tannery wastewaters with a battery of biotests[J]. Ecotoxicology & Environmental Safety, 2011, 74(4): 866-873. |
| [20] |
KOKKALI V, VAN DELFT W. Overview of commercially available bioassays for assessing chemical toxicity in aqueous samples[J]. Trends in Analytical Chemistry, 2014, 61: 133-155. |
| [21] |
CASSERI N A, YING W C, SOJKA S A. Use of a rapid bioassay for assessment of industrial wastewater treatment effectiveness[C]//J.M. Bell(Ed. ). Proceedings of the 38th Purdue Industrial Wastewater Conference. Purdue University(USA): Butterworth Publishers, 1983: 867-878.
|
 2024, Vol. 16
2024, Vol. 16 

